不吃“快餐”、只争first in class的康乃德
将患者的切身需求作为自己奋斗目标是每一个医药人涉足该领域的初衷,往大了说,大部分医药人都有一颗普世心。在康乃德联合创始人兼董事长潘武宾看来,专注、技术、创新、创始团队的和睦,是创业能否成功的关键因素。
佐证潘武宾这套方法论的,就包含其近八年所取得的成绩。2012年,潘武宾、郑伟两位30余年的老朋友联合创办了康乃德生物医药有限公司。这家看似初创年轻企业,在随后几年内分别完成天使轮、A轮及B轮融资累计融资金额达8000万美元,近期又有新的融资动态。
目前,康乃德推出了多款自身免疫病和炎症领域的原研药,值得注意的是,这些这些药是真正的原研药,而非稍微改变原研药的化学结构而得到的“高仿”原研药——Me too药。截止发稿,康乃德已有两款药物正在进行着不同时期的临床研究。
在自身免疫领域浸淫多年,只争first in class
“要想在一个领域有所建树,有竞争力,必须做自己熟悉且市场前景大的领域。”郑伟表示道。
2012年成立的康乃德,是潘武宾的第二次创业,但是郑伟首次自主创业。潘武宾曾以联合创始人的身份参与创建了“Crown Bioscience, Inc.(中美冠科生物技术有限公司)”,并先后任中国区总裁、中美冠科COO和执行副总裁。而郑伟在美国也是先后服务过三家自身免疫和炎症相关的纳斯达克上市企业。
潘武宾对此这样阐述到:“我们都在自身免疫病和炎症领域干了二十多年了。”虽然都是医药领域的项目,但在业务侧重点上却略有差异,现在的康乃德是一家临床阶段医药研发公司,致力于开发治疗自身免疫疾病和炎症的免疫调节剂新药。
康乃德是自带自身免疫病和炎症的基因,这使其有先天的优势,这也是在创新药“寒冬”就敢萌生出康乃德要做创新药的想法,按照潘武宾的话来说:“我们要做first in class,而不是Me too。”可见何其自信。
“2011年,中国创新药开始从‘寒冬’慢慢‘回春’。”郑伟补充说,“2011年前是创新药的‘冬天’,大家都没意识道‘春天就要到了’,以为‘冬天’之后还是‘冬天’,就连当时的一些资本都在说不投创新药。”郑伟补充到:“国产创新药研发从2011年逐渐步入春天,国内逐渐利好的创新药市场大环境,让一些没有及时转型的企业错失良机,好在康乃德不在其中,踏国产新药研发的春风稳步发展。”
从政策方面来说,2009年5月,国家正式启动重大新药创制专项工作,其中大半资金用于鼓励企业新药项目研发。“其实,现在中国医药市场正处于从仿制药到创新药的起飞阶段,医药工业转型与国家提出的供给侧改革转型是契合的。”易凯资本董事总经理张骁表示。但万事开头难,起初很多人还是持“观望”态度。如今,近100个品种获得新药证书,获批新药数量是专项实施前的5倍左右,充分说明了在政策层面对创新药的持续、坚定的支持。
据智研咨询发布的报告,2010-2017年,在我国获得全球首批的NME(新分子实体)/BLA(新生物制品)药物就达到18个。2018年,国家药监局通过优先审批,前所未有地批准了包括10个国产新药在内的48款全新药物快速上市。国内创新药的利好是“质”与“量”双管齐下。
乘着政策及大环境利好的快车,在康乃德成立的第三年也就是2015年,康乃德基于T细胞免疫调节自主研发出了第一个新药发现平台,该平台技术也成功获得了专利。依托这一平台,康乃德做出了其CBP-307、CBP-201等核心产品。
值得注意的是,成立至今康乃德员工人数不超过五十人,却撑起公司近4亿元的估值,这除了得益于康乃德“让专业的人去做专业的事”的经营理外,还与其郑伟、潘武宾、Mike A、Lei Sun、Stuart J. Swiedler等技术管理层密不可分。
两款新药三种适应症步入临床,抢滩百亿美元的自身免疫病市场
康乃德目前的产品管线主要包括三款候选药物,包括CBP-307、CBP-201和CBP-174。其中,CBP-307的临床数量与进展最为领先。
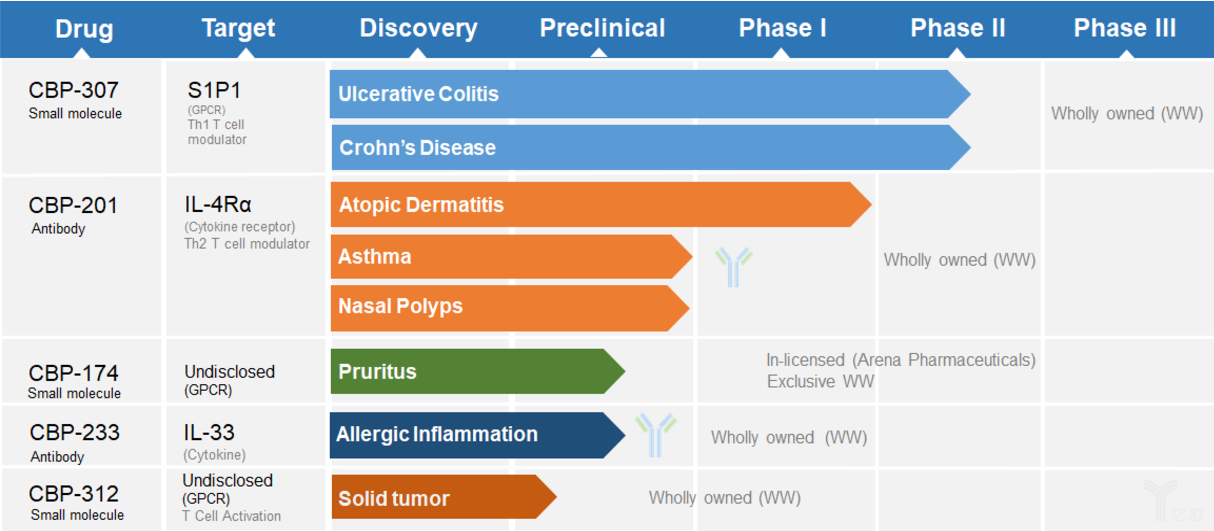
CBP-307是康乃德正在开发一个高度差异化的小分子S1P1和S1P5口服调节剂,主要用于治疗包括多发性硬化症、炎症性肠病、牛皮癣、类风关等自身免疫疾病。目前已经在澳大利亚和中国完成临床I期的随机、双盲、安慰剂对照研究,评估了其耐受性、药代学和药效学试验,不仅如此,作为1.1类新药CBP-307已经进入Ⅱ期临床试验。
2019年1月,康乃德对外公布了其第二大产品——CBP-201在澳大利亚和新西兰针对在中重度特异性皮炎患者中的1b临床研究数据。数据表明,CBP-201与国际公认的湿疹标准生物疗法Dupliumab的临床数据相比,CBP-201在治疗4周后展现出疗效远比标准规定的16周要好,且其安全性也得到了肯定。预计在2020年第一季度,在包括美国及欧洲数十个临床试验中心入组超过200名患者,进行CBP-201治疗中重度特异性皮炎的2b全球临床研究。
CBP-201的潜在市场巨大,不少国际巨头也纷纷涉足CBP-201的相关适应症领域。2019年12月7日,强生对外宣布,其以7.5亿美元买下Xbiotech研发的IL-1α抗体Bermekimab在皮肤科适应症的全球权益。需要注意的是,当时Bermekimab仅有临床Ⅰ期数据,根据协议,强生将负责正在进行的特应性皮炎(湿疹,AD)和化脓性汗腺炎(HS)二期临床研究。
不仅如此,赛诺菲也曾在2019年业绩报告中指出,其产品管线中的肿瘤和免疫炎症领域的药品在2019年贡献了双位数的增长。其中,表现最为突出的莫过于治皮炎的Dupixent,上市仅3年累计销售额就突破了20亿欧元,赛诺菲直言Dupixent的销售峰值有望突破100亿欧元。
除此之外,康乃德旗下还有另外三款产品CBP-174、CBP-233、CBP-312及CBP-201的部分适应症研究还处于临床前阶段。其中,用于治疗鼻炎、皮炎的口服化药CBP-174是康乃德产品线中为数不多从国外引进的产品。
值得一提的是,康乃德在知识产权方面也可圈可点。康乃德十分注重产品的合法权益,其管线内自主研发的产品几乎都有全球知识产权,以保障康乃德每个候选药物在全球发展和商业化的合法权益。甚至是从国外引进的CBP-174,康乃德都有该药的全球独家专利授权。也正是这种超前的知识产权意识,使康乃德践行着其“掌握住核心价值,让专业的人去做专业的事”的经营理念,同时成就了康乃德灵活地独立发展以及其价值最大化。
不难发现,目前康乃德已进入临床的药物都可治疗多个自身免疫病的适应症。有报道指出,自身免疫病市场是除肿瘤市场外,规模最大、增长速度最快。预计2020年,全球自身免疫疾病市场规模将达到4200多亿,中国预计2023年潜在市场规模达377亿,复合增长率高达23%。郑伟也表示,目前全球范围内一个自身免疫病的适应症的市场规模就高达50亿美元。
然而,看似美好的自身免疫病和炎症领域,在蓝海下还潜藏着很多挑战,例如,国内自身免疫病用药的市场教育至今尚未做好。张骁对亿欧大健康表示,自身免疫病确实有很大的市场,但在中国,大家在自身免疫病用药方面的态度大多是不太积极的,对于类似轻度慢性过敏性皮炎这种不致命的自身免疫病,更多的人并不会首选用药。
由此可见,康乃德虽然处在高速发展且前景可观的领域,但还得考虑实际情况。在成功研发好的产品的同时,康乃德还需要做好打“持久战”的思想准备,进一步完善市场教育。不过对此,康乃德似乎也是信心十足,除了在自身免疫病和炎症布局的这些药外,潘武宾对亿欧大健康表示,可能还会涉足罕见病领域,并且依旧会做first in class而不是Me too类药。

图片新闻
技术文库
最新活动更多
-
4月23日立即报名>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
4月25日立即报名>> 【线下论坛】新唐科技2025新品发布会
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论