创新药黄金赛道的卡位战:PD-1适应症“追逐”正酣
在国内PD-1/L1的赛道上,适应症的拓展成了抢滩点。
不久前,百济神州宣布NMPA(国家药品监督管理局)受理其PD-1抑制剂百泽安(替雷利珠单抗注射液)用于治疗既往接受过治疗的不可切除肝细胞癌患者的新适应症上市申请。至此,替雷利珠单抗注射液完成了国内第5项上市申请。目前,它已获批用于R/R cHL(复发/难治性经典型霍奇金淋巴瘤)和UC(尿路上皮癌),并提交了覆盖鳞状和非鳞状非小细胞肺癌(NSCLC)的两个新适应症。
替雷利珠单抗是一款人源化IgG4抗程序性死亡受体1(PD-1)单克隆抗体。PD-1类药物不同于传统的化疗和靶向治疗,它主要通过克服患者体内的免疫抑制,重新激活其自身的免疫细胞杀伤肿瘤。抗PD-1抗体药物是广谱抗肿瘤药,可用于多种恶性实体瘤和部分血液瘤,可与化疗、放疗、靶向、抗血管等联合治疗。

图片来自The Pharmaceutical Journal, 2014
另外,最近恒瑞医药的PD-1抑制剂卡瑞利珠单抗也最新获批了两项适应症——非鳞状NSCLC和食管鳞癌,国产 PD-1 药物正迎来密集收获期。
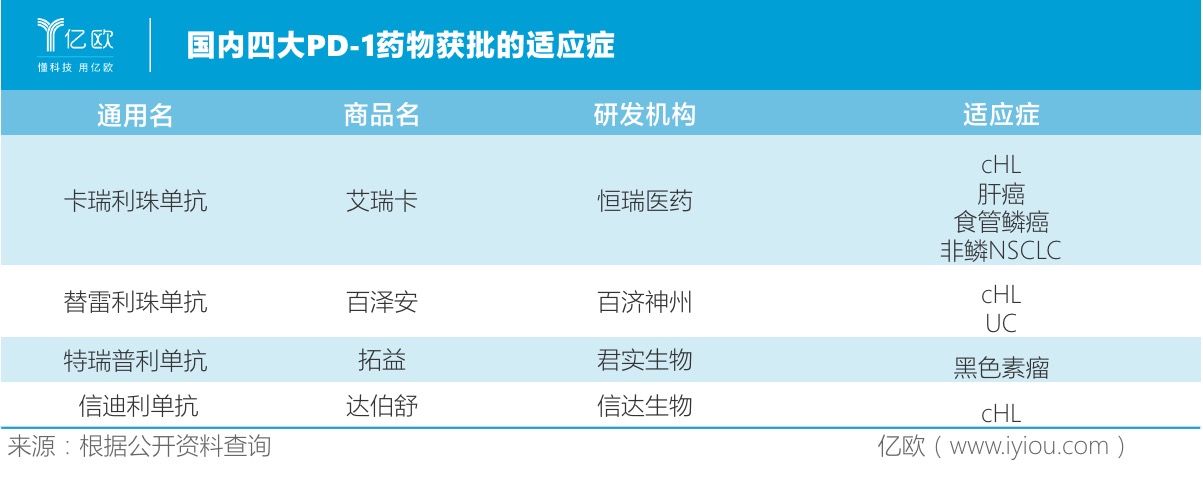
实际上,国内PD-1/L1抑制剂“2+4+X”的市场格局日渐清晰:“2“指的是默沙东的可瑞达?(帕博利珠单抗)即K药和百时美施贵宝的欧狄沃(纳武利尤单抗)即O药;“4”则是百济神州的百泽安(替雷利珠单抗)、恒瑞医药的艾瑞卡(卡瑞利珠单抗)、君实生物的拓益(特瑞普利单抗)和信达生物的达伯舒(信迪利单抗);X指的是阿斯利康的英非凡(德鲁单抗)、罗氏的泰圣奇(阿替利珠单抗)等。
从各家财报数据看,4家国产PD-1药物表现不俗。2019年,信达生物的信迪利单抗销量超10亿元。恒瑞医药没有具体披露卡瑞利珠单抗2019年的销售额,但业内猜测称它实现了约10亿元的销售。截至2019年底,君实生物的特瑞普利单抗销售额达7.74亿元。百济神州的替雷利珠单抗于2020年3月在国内商业化,2020年一季报显示,该产品收入约1.457亿元。初步预计,它今年全年的销售额有望突破10亿元。
根据弗若斯特沙利文分析,预期2023年中国抗PD-1/L1抑制剂市场规模将达到664亿元,并将于2030年增长至988亿元。在巨大的市场诱惑下,各大企业正在加速产品研发速度,通过拓展适应症的数量抢食市场份额。
相对于其他三家企业,百济神州的PD-1单抗上市较晚,但其在适应症的“追逐战”中逐渐占据上风。百济神州在适应症的数量上位居第二,拥有两项获批的适应症。君实生物、信达生物则仅有一项适应证获批。
近日,百济神州高级副总裁、生物药研发负责人李康博士接受了亿欧大健康的采访。在谈及替雷利珠单抗在一众PD-1抑制剂中的优势时,他表示其团队主要做了两点改变,让它有了药学基础上的优势。
首先在Fc段(可结晶段,相当于Ig的CH2和CH3结构域)同样使用了IgG4(人类免疫球蛋白G4)亚型结构,但在这个亚型上他们做了6个氨基酸的变化。李康表示:“我们做这个改变,就是让PD-1抗体不再结合巨噬细胞,使巨噬细胞不再伤害抗癌的T细胞。”
第二个改变则是在Fab区(可变区)。“我们反复做了很多的结构优化方案,希望抗体结合到PD-1上以后,结合的很持久,能够和配体很好地竞争。”李康解释,如果改造完后的抗体还像人的抗体,那么它会产生很好的药代作用,抗体在体内半衰期就会更长。
李康表示,目前百济神州的替雷利珠单抗共有16项注册性临床试验在中国和全球范围内展开,其中包括12项III期临床试验,覆盖包括肺癌、肝癌、胃癌、食管癌等多个癌种。
竞争“赛”点:适应症从“小”到多
2018年6月,美国百时美施贵宝O药正式获得NMPA批准上市,成为中国第一款上市的PD-1单抗药物,距美国获批上市仅4年。随后的两年里,中国迅速批准了8种PD-1/PD-L1免疫抑制剂,其中就包括四款国产PD-1单抗。
为了尽快获得审批、快速进入市场准入通道,国内药企都首先瞄准了竞争少、成功率较高的小适应症。其中,百济神州的替雷利珠单抗、恒瑞的卡瑞利珠单抗和信达生物的信迪利单抗的首个获批适应症为经典型霍奇金淋巴瘤(cHL),君实生物的特瑞普利单抗则是黑色素瘤。
自2014年以来, PD-1/PD-L1抑制剂共有54种适应症获得美国FDA批准,其中可瑞达获批23种,欧狄沃获批16种。相比之下,国内的四大PD-1药物仅有6项不同的适应症获批。
国内企业逐渐意识到,适应症的拓展能够带来市场份额的增量,PD-1/PD-L1的研发竞争愈发激烈。根据CDE(国家药品监督管理局药品审评中心)临床试验登记的公开数据显示,截至7月8日,目前PD-1/L1单抗药物共有199项Ⅰ~Ⅲ期的中国临床试验正在进行。其中四大PD-1药物涉及的适应症包括肺癌、肝癌、鼻咽癌、胃癌、乳腺癌、妇科肿瘤等。
不难看出,这四家企业均采取先快速上市、再辅以“小适应症+大适应症”快速扩大市场份额的竞争策略。与此同时,肺癌、胃癌、肝癌、食管癌四大适应症正在成为国内PD-1单抗临床研发的重点。按照报告《Cancer Statistics in China, 2015》,和美国以肺癌为主不同,这四大实体瘤约占国内肿瘤诊断的57%,而美国这一比例仅有18%。四大实体瘤均可用抗PD-1治疗。除了抗PD-1治疗适应症广,国内的适用人群基数也较大。据国信证券经纪研究所预计,中国抗PD-1治疗核心适用人群总计204万人。
另外,国内企业逐步布局四大适应症,也是差异化竞争使然。国外企业已占据肺癌等主要适应症的高地,市场竞争激烈。但在中国区域的四大实体瘤的发病/死亡约占全球50%,其临床试验竞争压力较小。
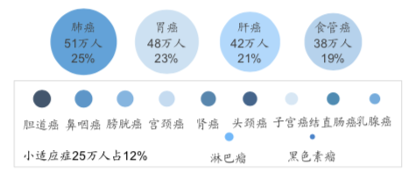
图片来自国信证券经济研究所(资料来源:CA: A Cancer Journal for Clinicians, 2016)
肺癌:PD-1/L1抗体的“必争之地”
肺癌是PD-1/L1抗体的“兵家必争之地”,目前国内已上市的8款PD-1单抗在适应症领域均有交叉,尤其是肺癌领域。肺癌主要分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)两种,其中NSCLC是最常见的类型,约占所有病例的85%,因此NSCLC成为PD-1/L1抗体适应症竞争最激烈的领域。其中非鳞状NSCLC占NSCLC70%,更为难治的鳞状NSCLC占30%。
百济神州的替雷利珠单抗也着重在肺癌领域布局,目前共有5项有关肺癌的临床试验在全球同步展开。

替雷利珠单抗全面布局肺癌领域
首先在鳞状NSCLC适应症方面,在不久前的ASCO大会上,百济神州公布了替雷利珠单抗联合化疗一线治疗晚期鳞状NSCLC的Ⅲ期临床(RATIONALE 307研究)数据。
对于具体的数据表现,李康介绍,替雷利珠单抗联合白蛋白紫杉醇加卡铂组的客观缓解率(ORR)达到74.8%,替雷利珠单抗联合紫杉醇+卡铂组的ORR也达到72.5%,而化疗对照组的ORR仅为49.6%。另外替雷利珠单抗联合白蛋白紫杉醇加卡铂组患者的中位无进展生存时间(mPFS)得到显著提升,患者的疾病进展风险降低了52%,患者的缓解持续时间(DoR)提升到单用化疗方案的2倍左右。
目前来看其疗效还是可期的,这也是首个在该疾病领域获得成功的中国Ⅲ期研究。替雷利珠单抗有望成为继K药之后,第二个在鳞状NSCLC适应症临床成功并最终上市的PD-1药物。
其次,替雷利珠单抗联合化疗用于治疗一线晚期非鳞状非小细胞肺癌的RATIONALE 304研究也已于今年4月公布了阳性结果,该新适应症上市申请已被NMPA受理。
替雷利珠单抗单药治疗晚期二/三线NSCLC患者的全球多中心3期注册临床研究(RATIONALE 303研究)已完成全球患者入组,其另一项联合含铂双药化疗治疗一线广泛期小细胞肺癌(SCLC)患者的Ⅲ期临床试验RATIONALE 312研究也正在进行中。另外,它还联合含铂类双药化疗开展可切除的II期和ⅢA期NSCLC的新辅助和辅助治疗研究(RATIONALE 315研究)。
在工艺研发和生产上,百济神州选择和勃林格殷格翰合作。 “我们希望能更好地和国际接轨,(替雷利珠单抗)不仅能在中国也能在欧美等地区获批。在这方面,勃林格殷格翰有很多经验。”李康介绍。
谈及未来替雷利珠单抗是否会进入医保,他表示百济神州正在积极准备。今年3月,百济神州与中国初级卫生保健基金会联合推出“为你,千方百济”患者援助项目,长期使用替雷利珠单抗进行治疗的患者年治疗费用最低为10.69万元。以信迪利单抗为例,它纳入医保后价格已经大幅平民化,和过去动辄三五十万一年的治疗费用相比,年治疗费用已经降到10万以下。若替雷利珠单抗后期能顺利进入医保目录,国内患者的药物可及性有望得到提升。
目前百济神州正在积极探索商业支付方式,尽可能降低患者的支付负担。替雷利珠单抗已进入由腾讯旗下保险代理平台微保联合泰康在线、镁信健康推出的“药神保抗癌特药保障计划升级版”药品报销目录。此外,替雷利珠单抗还已被纳入苏州城市定制化的普惠型补充医疗保险“苏惠保”、成都市民专属普惠式商业健康保险“惠蓉保”以及杭州城市定制化的普惠型补充医疗保险“杭州市民保”等的药品报销目录。
联合治疗,抗PD-1/L1未来可期
不可否认,各家公司适应症的数量将在很大程度上决定自身的竞争优势。未来谁能拓展更多的适应症,谁有更合理的价格,谁自然抢占市场份额。除了拓展适应症,与其他药物的联合治疗也是PD-1/L1接下来的研发重点。目前其临床开发的重点是四大适应症晚期一线联合治疗方案。
在李康看来,PD-1联合治疗最好的方向是化疗。这一点也体现在肺癌的临床研究中,PD-1/L1抗体与化疗的联用取得了较好的疗效。比如百济神州的替雷利珠单抗联合化疗一线治疗晚期鳞状非小细胞肺癌的Ⅲ期临床取得了较为可观的数据表现。更早之前,默沙东宣布PD-1抗体K药联合化疗用于晚期无EGFR和ALK基因突变的非鳞非小细胞肺癌的一线治疗的三期临床试验keynote-189获得成功。
此外,PD-1/L1与下一代新的免疫制剂的联合,在加强肿瘤的识别、减少毒性方面有着治疗优势,或将成为联合治疗的热门方向。百济神州也在这方面开展了一些新尝试,比如替雷利珠单抗与PARP抑制剂的联合、与Zymeworks ZW25的联合用药。
李康表示,替雷利珠单抗与Mirati Therapeutics公司的小分子药物sitravatinib(血管生成抑制剂)的联合用药效果不错。“它具有改变基因组调控功能的作用,也能改变肿瘤微环境。”另外,百济神州产品管线中的CTLA-4抑制剂,目前它和PD-1的联合方案也有了成功的案例。
靶向TIGIT产品也是PD-1/L1联合治疗的潜力趋势。李康认为,TIGIT单抗是PD-1联合用药中最有意义的药物之一。最近,罗氏表示会展开两项PD-L1与TIGIT联合用药的II期临床试验,这是两个免疫药物的联合,分别针对NSCLC和SCLC。百济神州的产品线中也有一款TIGIT 抗体,该产品与替雷利珠单抗联合用于治疗NSCLC也被寄予厚望,其Ⅰ期的剂量爬坡已近尾声。
另外,百济神州还将替雷利珠单抗和管线中的OX40重组蛋白、TIM-3抑制剂、ibrutinib(泽布替尼,BTK抑制剂)结合,开展联合用药。其中,它和泽布替尼的联用主要聚焦在血液瘤方面。“不光是联合百济神州自己的药,我们希望联合任何能给病人带来益处的治疗手段。”李康说道。
作者: 秘丛丛 来源:亿欧

图片新闻
技术文库
最新活动更多
-
4月23日立即报名>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
4月25日立即报名>> 【线下论坛】新唐科技2025新品发布会
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论