国内抗体药产业尚处早期,政策该如何推动产业健康发展?
“首先国内的抗体药基础研究和研产转化能力的不足;其次关键研发技术平台的掌控能力不够,主要的技术目的还掌握在美日公司手里而像细胞株这样的平台重要的技术模块也为欧美公司所拥有;另外国内企业的工艺经验不足,设备材料严重依赖进口,非常不利于商业化大生产的成本控制。”艾昆纬中国(IQVIA)管理咨询总监柴研表示。
抗体药物是以细胞工程技术和基因工程技术为主体的抗体工程技术制备的药物。在癌症等大病治疗中,它较好的疗效和高度特异性显现出巨大的使用前景。
截至2019年底,FDA认定的165个“突破性疗法”中,抗体药物疗法占62个。目前,国内仅有5个上市的抗体生物类似药,而第一个生物类似药在去年才获批。中国该产业仍处于起步阶段,并且其产业的核心能力还存在着较多的短板。
7月23日,中国药品安全合作联盟联合IQVIA共同发布了《中国抗体药产业健康发展报告》。该报告着眼于我国抗体药产业的现状和政策环境,探讨如何推动产业健康发展。
抗体药受监管机构认可,其研发生产及仿制难度较大
抗体药是一种特殊的大分子生物药,在癌症等大病治疗中表现出色。例如1997年上市的利妥昔单抗为非霍奇金淋巴瘤患者提供更优的免疫化疗方案;曲妥珠单抗大幅提高乳腺癌患者的生存率和生存期。而近年来抗体药 PD-1为癌症患者带来免疫疗法的新选择,使癌症患者获得更高的生存率和更长的总生存期。
各国监管机构也十分认可抗体药的治疗效果。美国FDA从2012年推行“突破性疗法”政策,为疗效显著的药物提供政策优惠待遇。截至2019年底,FDA认定的165个“突破性疗法”中,抗体药物疗法占62个。在国内,目前药监局共发布两批临床急需境外新药名单,共包括78个药品,其中抗体药就占22个。
抗体药疗效好、特异性高,但抗体药的诞生,却挑战重重、并非易事。不同于小分子化学药,抗体药是大分子生物药,结构复杂、研发难度高、生产难度大。一款抗体药物的研发需要历时十几年、耗费几十亿元。而且抗体药对于生产工艺十分敏感,其生产过程涉及上千个工艺步骤,工艺的微小差异都会影响药品的质量和疗效。必须高度重视抗体药的工艺提升和质控环节,保证患者用药安全。因此,需要为抗体药产业研发能力和生产能力的积累留下充分的积累和提升时间。
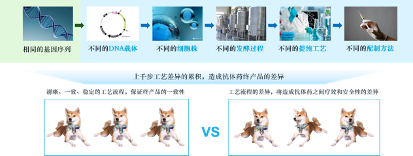
图1 生产工艺差异影响抗体药物产品性质
抗体药的仿制难度,同样远高于化学药仿制。如果将仿制化学药比作造自行车,那仿制抗体药的难度就类似造波音747飞机,仿制企业极难完全复制参比制剂(即被仿制的对照药品,多为原研药)的生产流程和蛋白质结构,因此仿造出来的药品被称为生物类似药。生物类似药与参比制剂“相似而不相同”,可能导致二者在质量和疗效上存在差异。
生物类似药和参比制剂的差异,对临床用药提出了更高的要求。临床中,可能会出现原研药和生物类似药之间的换药,也可能出现不同生物类似药之间的换药行为。值得注意的是,由于国内生物类似药上市时间极短,为确保用药安全,需要重视生物类似药临床经验的积累,推动临床用药决策的科学性。
我国抗体药产业处发展初期,产能和关键技术有待提高
我国抗体药产业还处于发展初期,生产能力和核心技术均有待提高。这些阶段性问题,仍需长期的技术积累和创新发展以补齐短板。
首先,我国抗体药的总产能需大幅度提高。目前我国抗体药实际总产能不足20万升,单个企业最高产能3.8万升。而邻国韩国总产能76万升,跨国企业产能多在20万升以上。由于抗体药的生产极其复杂,其产能的扩增需要经历漫长的过程。现有的产能是否满足患者需求和市场波动,这些问题值得关注。

图2. 抗体药物产能中外Top10企业产能对比(单位:万升,以哺乳细胞产能计算)
其次,产业的关键技术能力不足。因起步晚、基础弱,我国抗体药产业的核心能力有所欠缺。中国抗体药产业基础研究尚落后于欧美顶尖水平,研产转化能力有待提升,关键技术平台的建设刚刚起步,关键材料尚未实现国产,主要以进口为主。
对企业而言,成本控制是规模化的生产的关键。目前国内的抗体药企业在生产成本的控制方面依然较弱,企业严重缺乏成本优势。具体来看,导致国内企业成本高企的原因有很多,比如反应器的规模较小、蛋白的表达量较低、批次的成功率较低、设备的国产化率较低等。
这些能力不足,限制了我国抗体药产业的技术创新和竞争力提升,整个产业的发展需要充分的时间进行竞争力培育。
政策更需与产业协同发展
产业的健康发展离不开产业自身的能力建设,也离不开政府对产业的支持和引导。还处于成长初期的中国抗体药产业,政策需要起到三个方面的核心作用:一是塑造产业的良好预期,推动多渠道的资金对产业的投入;二是引导产业规范高质量的发展;三是强化产业研发能力。这三项核心任务分别对应创新发展政策、质量安全监管政策和医保采购政策。
目前,中国抗体药产业的政策环境分为三个相应的主要模块:产业创新发展、质量建设、市场准入。

图3. 中国抗体药产业发展框架
首先在产业的创新政策上,这涉及从基础研究到产业发展的全链条环节。国家需大力支持基础创新研究,激励成果的转化落地,同时大力培养创新领军人才,加大产业支持力度,健全知识产权保护体系,为产业的良好发展和技术安全保障提供持续的动力。
其次,质量安全监管政策方面,中国需探索符合本国国情的生物抗体药的临床管理规范的建设道路,完善抗体药物上市后的监管体系,协同相关部门以保障临床用药安全:
1.建设生物药临床规范,制定科学的以证据为基础的生物类似药临床使用规范,指导医生合理用药。
2.完善抗体药的监管制度,重点关注免疫原性问题和不良反应的差异问题,推动生物类似药用药安全的提升。
3.通过药监部门、卫生主管部门的协同以保障用药安全,推动药物上市后的安全研究,规范药房处方。
在提高国产抗体药的质量方面,课题组专家金春林(上海卫生和健康发展研究中心主任)认为可以利用国家治理优势,建立起抗体药物关键技术平台。“在使用中如何积累数据,在真实世界中的数据反馈给生产者,从而改进生产工艺也很重要。”他补充说。
最后,在抗体药的采购政策方面需要格外注重用药疗效、用药安全、用药经济性和产业能力等现实因素,在制定针对抗体药的采购模式时,需要综合考量抗体药的复杂性,医患多元的用药需求,临床用药安全,产业共存的能力,避免采购政策对采购发展、药品可及性、用药安全等方面形成冲击。
值得注意的是,医保采购政策与临床用药、药品供给和产业发展有着密切联系。金春林认为,抗体药还处于“婴儿期”的发展阶段,不适合纳入带量采购。带量采购的产品相对成熟,通过一致性评价后进行价格竞争才能纳入医保。
但在抗体药发展的过程中,医保也能够通过多元化形式支持发展和创新。“可以有限度地纳入医保报销范围,不一定都是80%(报销),也可以40%或50%。”金春林表示,不一定都采用带量采购,也可以根据疗效和风险分担来支付。
在卫健委卫生发展研究中心医疗保障制度研究室主任顾雪非看来,医保政策的基本价值取向还是追求性价比,就是卫生经济学价值。“假如生物药、抗体药出现临床上的重大突破,解决了患者很多临床急需,其实可以调高卫生经济学的阈值。”在英国已经有一些先例,一般而言一个新药进入NHS(英国国家医疗服务体系)可以支付的范围,它的成本效果预支是2到3万英镑。后来在一些重大的创新性的抗癌药物上,这个阈值就被提高了5万英镑。
作者: 秘丛丛 来源:亿欧

图片新闻
技术文库
最新活动更多
-
4月23日立即报名>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
4月25日立即报名>> 【线下论坛】新唐科技2025新品发布会
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论