半月斩获22亿元!Poseida用基因编辑打造新式CAR-T疗法
近日,动脉网获悉,生物技术公司Poseida Therapeutics在IPO中筹集到资金2.048亿美元(约合14.3亿人民币)。IPO前夕,7月7日,Poseida Therapeutics公布其IPO具体条款,计划以14-16美元的价位区间发行1000万股,拟募资1.5亿美元。公司上市当天股价上涨,首次公开募股定价在预期区间的最高值,7月12号以每股16美元开盘。此次募集到的资金显然超出了Poseida Therapeutics的预期。
其实,Poseida在2019年年初就曾递交过IPO申请,拟在纳斯达克上市,拟募资1.15亿美元。但在几个月后,它获得了由Novartis牵头的1.42亿美元C轮融资,之后便撤销了上市申请。今年6月底的时候,又传出Poseida完成1.1亿美元(约合7.7亿人民币)D轮融资的消息。短短半月,Poseida竟拿下3.148亿美元(约合22亿人民币)!
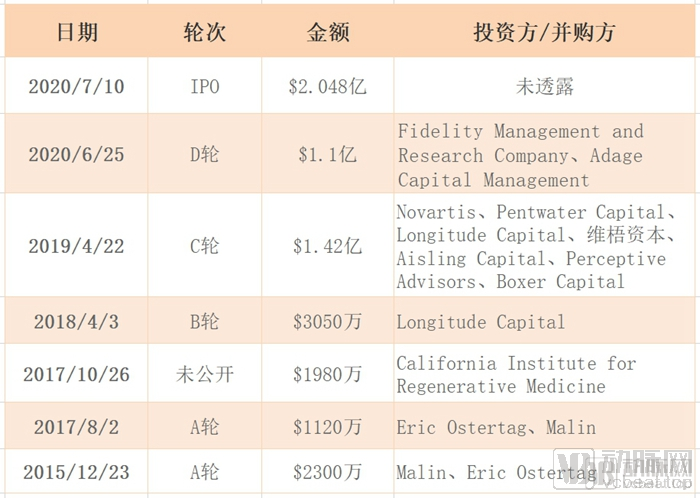
Poseida Therapeutics历史融资情况
可以发现,Poseida Therapeutics近年在投融资市场上表现地十分活跃。那么,它到底研究着些什么,竟惹得各大投资机构频频解囊,助其在短短几年拿下亿万融资?下面我们来一探究竟。
创始人:搞得好科研,也做得好管理
Poseida Therapeutics是一家临床阶段的生物技术公司,成立于2014年,总部位于加利福尼亚州圣地亚哥,由Transposagen Biopharmaceuticals公司衍生而来。Poseida Therapeutics旨在将最顶尖的非病毒基因工程技术用于攻克各式疑难杂症,破解医学难题。目前,该公司正在独立研发一种自体和同种异体CAR-T(嵌合抗原受体T细胞)候选产品,该产品用于治疗血液系统恶性肿瘤、实体瘤以及一些罕见遗传病。
Poseida的创始人兼首席执行官Eric Ostertag还曾是生物技术公司Vindico NanoBioTechnology的联合创始人兼首席执行官。Vindico致力于发现、开发和商业化基于纳米级微粒技术的人体疗法。
Ostertag在威斯康星大学麦迪逊分校度过了他的本科时光,拿到了遗传学的学士学位。后来,他深入研究基因领域,在宾夕法尼亚大学获得了分子生物学的博士学位。
Ostertag在商界拥有超过12年的执行管理经验。担任Transposagen首席执行官期间,他在基因编辑领域发表了近二十篇同行评审的文章和评论,还因此获得了美国人类遗传学会和美国Apheresis学会的科学和临床奖项。
有这样的带头人在,PiggyBac DNA修饰系统(基因编辑系统)坐稳技术平台的第一把交椅,也是顺理成章。
非病毒载体让Poseida的CAR-T疗法更安全高效
Poseida Therapeutics公司的主要技术版块分为piggyBac DNA修饰系统、CAS-CLOVER基因编辑、基因运输系统等。每个技术平台又包含着具体的基因操作工具和系统。下面进行简要介绍。
>>>>
piggyBac DNA修饰系统【最核心技术】
当前,大多数CAR-T疗法产品都是使用基于病毒的制造方法生产,存在一定毒性,对患者也会造成安全上的隐患,这也是CAR-T疗法饱受争议的一点。同时,基于病毒制造的CAR-T疗法在运输遗传信息能力上也很有限。
Poseida非病毒piggyBac平台不使用病毒载体来创建CAR-T疗法产品,而是利用基因编辑技术将CAR分子基因呈递给T细胞。这种方法最显著的优势,是它能够生成具有高活性TSCM细胞的CAR-T产品。这种“版本”的CAR-T疗法可以引起更持久的高活性反应,毒性也更低。除此之外,这种方法明显降低了制造成本,还缩短了制造时间。

piggyBac技术平台运作机制
众所周知,T细胞在免疫应答中起着核心作用。CAR-T疗法即是通过设计改装“T细胞”来达到杀死癌细胞的目的。但正如幼童要长大成人方能成就一番本事,幼T细胞在成为杀伤性T细胞(即T效应细胞)攻击外来病原体和癌细胞之前,会经历多个阶段的生长和发育成熟。人工改装的“T细胞”自然和“原装”的T细胞在很多方面不能并驾齐驱。
这就意味着,尽管可以设计改装“T细胞”有效杀死癌细胞,但它们寿命短,仅能维持数周。这也是目前患者接受CAR-T疗法后却仍会出现复发情况的主要原因。目前,还没有找到一种合适的初始剂量,在不对人体造成伤害的情况下还完成首次就消除掉人体内所有癌细胞的使命。
对于这个问题,Poseida研究并采用了非病毒piggyBac?DNA修饰系统设计开发出一种分化CAR-T产品。
这种产品主要由最早的T细胞组成,称为干性记忆T细胞(TSCM细胞)。TSCM细胞具有长寿、随人体内环境自我分化等功能,能重构T细胞亚群(包括TEFF细胞)。在临床试验中,它们已被证明在植入人体后仍可存活数年,从而解决了传统人工“T细胞”寿命短的问题。

TSCM细胞的分化流程
相较现有的CAR-T疗法,Poseida设计的高活性TSCM细胞将对更多的癌细胞进行逐步“围剿”和“扫荡”,诱导更少的炎症细胞因子反应并改善CAR-T候选药物的耐受性。

Poseida CAR-T疗法与传统CAR-T疗法比较所存在的优势
>>>>
CAS-CLOVER基因编辑

Poseida的Cas-CLOVER的基因编辑技术结合了第一代CRISPR的优势(易于设计,低成本,多功能)和同型二聚体核酸酶系统(如TALEN)的特异性。Cas-CLOVER易于操作使用,在临床前研究中显示出低至无脱靶活性,可以有效编辑休眠T细胞中的基因,具有明显的耐受性优势。
重要的是,在Poseida的CAR-T细胞疗法中,它允许在同种异体候选药物中维持完整的TSCM产品组成,具有非常大的研究前景。Poseida专有的基因编辑平台Cas-CLOVER和TAL-CLOVER的相关技术也可以用于体内基因治疗。
>>>>
基因运输系统

基因运输系统
Poseida拥有包括纳米粒子程序在内的多种基因传递技术平台,可将其制造产品传递到各个组织。基因传递系统的开发,也扩大了公司在基因治疗方面的临床前研发规模。这为Poseida改装制造更完美的T细胞,设计更快、更有效、更安全的基因疗法以攻克实体瘤打下基础。
一流的基因编辑技术打底,新式CAR-T疗法初现光芒
在piggyBac DNA修饰系统、CAS-CLOVER基因编辑等技术平台的支持下,Poseida打造了包括自体项目和异体项目等的在研管道产品线。

Poseida Therapeutics在研项目管道
自体项目
Poseida的自体CAR-T产品候选物利用piggyBac DNA修饰系统开发,通过基因编辑修饰患者自身的细胞达到治疗疾病的目的。自体项目主要包括P-BCMA-101、P-PSMA-101等候选产品。
>>>>
P-BCMA-101
Poseida最核心的候选产品P-BCMA-101是靶向B细胞成熟抗原或BCMA的自体CAR-T疗法,用于治疗复发/难治性多发性骨髓瘤。目前公司正在招募复发/难治性多发性骨髓瘤患者进行2期试验。
>>>>
P-PSMA-101
P-PSMA-101是Poseida第一个针对前列腺特异性膜抗原或PSMA的实体瘤自体CAR-T产品候选药物,正在开发用于治疗mCRPC患者。在临床前研究中,P-PSMA-101已被证明在动物实验中能100%将肿瘤细胞消除至无法检测的水平,在较低剂量的情况下也仅发生了一次复发。
异体项目
Poseida的同种异体CAR-T产品候选物使用了源自健康供体的一些细胞作为起始材料开发,使用piggyBac和Cas-CLOVER基因编辑技术进行修饰,以减少或消除同种异体反应。这些候选产品可以采用冷冻的方式保存,将来可以直接使用。异体项目主要包括P-BCMA-ALLO1、P-MUC1C-ALLO1、P-PSMA-ALLO1等候选产品。
>>>>
P-BCMA-ALLO1
P-BCMA-ALLO1是Poseida针对BCMA的第一个同种异体CAR-T产品候选药物,被开发用于治疗复发/难治性多发性骨髓瘤患者。Poseida将P-BCMA-ALLO1设计为完全同种异体,通过基因编辑消除或减少了其同种异体反应。
>>>>
P-MUC1C-ALLO1
P-MUC1C-ALLO1是Poseida用于治疗多种实体瘤的同种异体CAR-T产品候选物,目前处于临床前开发中。P-MUC1C-ALLO1有潜力治疗多种源自上皮细胞的实体瘤,例如乳腺癌,结肠直肠癌,肺癌,卵巢癌,胰腺癌,肾癌等。同样,该产品也已经通过基因编辑消除或减少了同种异体反应。
写在最后
Poseida依托基因编辑技术,采用非病毒载体的新式CAR-T疗法努力攻克着血液系统恶性肿瘤、实体瘤以及一些罕见遗传病,虽然目前还未看见其最终成效,但前景确实十分诱人。医疗技术领域上的创新总是在不断刷新、颠覆着我们目前的认知。
在人类进一步臆想“长生不老”的愿望之前,医疗首先要思考的是如何击败目前威胁人类正常生命旅程的魔鬼们,癌症首当其冲。Poseida的新式CAR-T疗法是否是人类最终击败癌症的大功臣?亦或是人类在战胜癌症的漫漫长途上一次微乎其微的普通尝试?寄一份期望,投两份关注,让我们拭目以待。
作者:陈宣合

图片新闻
技术文库
最新活动更多
-
4月23日立即报名>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
4月25日立即报名>> 【线下论坛】新唐科技2025新品发布会
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论