4-1BB双抗及Combo策略
前言
肿瘤坏死因子受体超家族(TNFRSF)是一个由 29 个成员组成的蛋白质超家族,在人类免疫系统中发挥着重要作用。
CD137(4-1BB)是TNFRSF成员之一,TNFRSF成员的特征是通过形成富含半胱氨酸胞外结构域的二硫键结合TNF的能力。与其他TNFRSF成员一样,三个单体的4-2BB与三聚化的CD137L结合,激活细胞内信号。
CD137在抗原暴露后迅速在CD4+和CD8+T细胞上表达, CD137和激活T细胞上的T细胞受体(TCR)能向T细胞传递共刺激信号,从而导致T细胞增殖、存活,记忆形成和更强的细胞毒性和细胞因子产生的效应器功能。
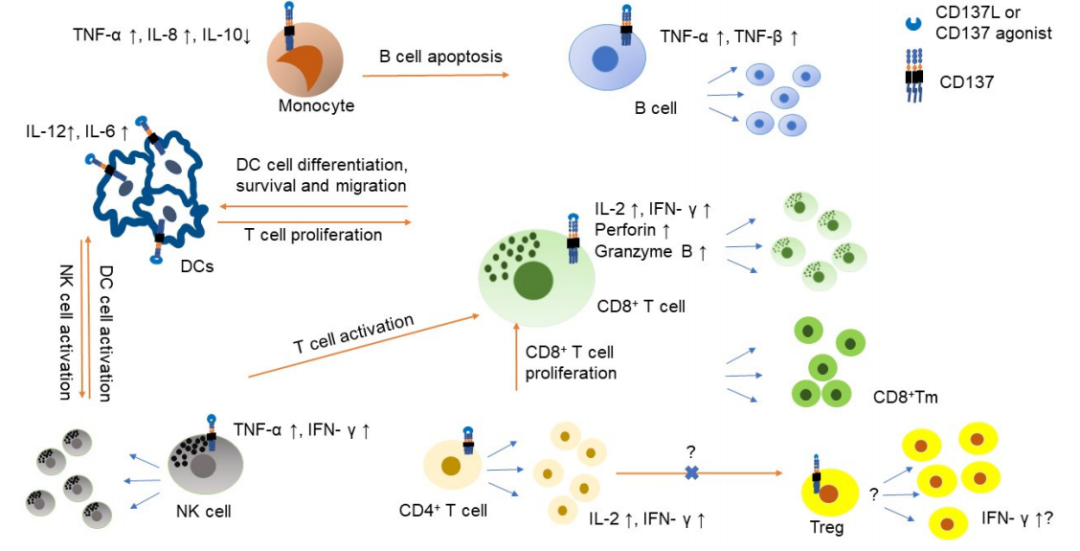
IL-2或IL-15可诱导NK细胞表达CD137,刺激NK细胞产生IFN-γ, 进一步支持T细胞活化。CD137信号可促进CD8+T细胞增殖、存活、增强细胞毒性和代谢适应性,并可产生CD8+记忆T(Tm)细胞。CD137激活后,CD4+和CD8+T细胞都产生IL-2和IFN-γ。CD137在T调节细胞(Treg)中的功能存在争议,CD137激活可导致Treg增殖,但可改变Treg产生细胞毒性或辅助效应。
单核细胞也表达CD137,激活CD137可诱导产生TNF-α和IL-8, 抑制IL-10 ; CD137激活也有助于单核细胞向树突状细胞(DC)分化, 同时也有助于DC细胞产生IL-12和IL-6。然而,CD137激活也使单核细胞极化为M2巨噬细胞,并促进B细胞凋亡。
4-1BB的双抗
在针对TNFRSF共刺激受体的临床试验中,CD137似乎是最有希望的靶点。
为了在维持药效的同时降低全身性CD137激动剂对肝脏的毒性,用同时与肿瘤相关抗原(TAA)结合的双特异性分子靶向CD137,将CD137+T细胞激动剂限制在肿瘤微环境中似乎是一种理想的方法。
首先,只有暴露抗原的T细胞(CD137+T细胞)参与靶向TAA,因此,靶向非肿瘤毒性的细胞因子释放综合征(CRS)可以最小化。
第二,CD137靶向双特异性抗体可能比CD3靶向双特异性抗体对抗原丢失更耐受,因为CD137刺激可独立于MHC或抗原扩增肿瘤反应性记忆T细胞。记忆性T细胞池扩大了,就可以识别多种肿瘤抗原。
最后,相比CD3+T细胞导向, CD137的激活可以减轻T细胞衰竭。数据表明,CD137共刺激可恢复小鼠耗尽的CD8+TIL的功能,延长细胞毒性T淋巴细胞(CTL)的持续时间,增强CTL功能。
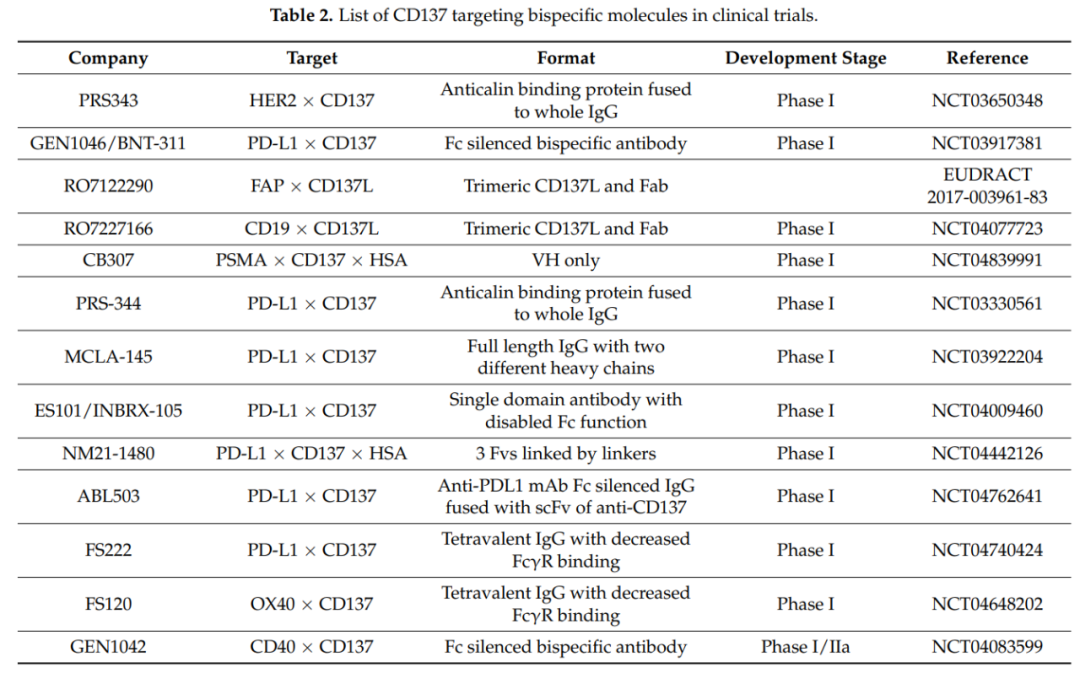
上表总结了CD137靶向双特异性分子的临床研究进展。
PRS-343
一种靶向HER2和CD137的双特异性分子,目前正在进行HER2阳性实体瘤的I期临床研究。在接受有效剂量治疗的患者中(n=33),12%的患者达到ORR,包括1个CR,疾病控制率(DCR)为52%,没有DLT报告。
引人注目的是,在中枢神经系统中也没有CRS或毒性的报道,这突出了CD137靶向与CD3靶向双特异性化合物的进一步优势。PRS-343在临床上与atezolizumab联合应用也有报道,但联合应用似乎缺乏叠加效应。
GEN1046
是一种靶向PD-L1和CD137的双特异性抗体。PD-L1作为TAA,同时GEN1046也抑制PD-L1通路的信号。在1期临床实验中,虽然未达到MTD,但报告了3级肝毒性。在接受有效剂量治疗的56名患者中有4例PRs,DCR 65.6%。在队列扩展试验中,观察到了先前使用检查点抑制剂治疗的NSCLC患者的初步抗肿瘤疗效。这两项研究支持CD137靶向双特异性分子在实体瘤中的应用。
RO7122290和RO7227166
分别是独特的CD137L三聚体与抗成纤维细胞活化蛋白(FAP)和CD19的Fab的融合蛋白。
在一项I期临床研究中评估了RO7122290单独或联合atezolizumab的安全性和临床疗效。单药治疗的临床疗效有限,与atezolizumab联合治疗也不太理想。目前尚不确定抗药物抗体(ADA)是否会对疗效产生负面影响,因为据报道,在失去疗效的可评估患者中,ADA阳性率达到20%。RO7227166也正在进行第一阶段的研究。
ES101/INBRX-105
是另一种PD-L1和CD137的双特异性化合物,目前处于一期临床研究的队列扩展部分。据报道,ES101/INBRX-105单药治疗的临床疗效在18例患者中有8例患者病情稳定,观察到肿瘤体积最大减少20%。与pembrolizumab的联合研究正在进行中。
目前,在第一阶段的临床研究中,还有很多针对CD137的双特异性抗体分子。其中CB307,靶向前列腺特异性膜抗原(PSMA),FS120和GEN1042也非常有趣,它们同时针对两个共刺激受体:OX40/CD137和CD40/CD137。
4-1BB靶向分子的联合治疗
检查点抑制剂
对HPN424和RO7122290的临床研究显示了与PD-L1抑制剂联合应用的潜力。
对33例实体瘤患者进行了Utomilumab 与pembrolizumab联合治疗的评估,联合治疗获得了26%的ORR,包括1个CR,但是,与pembrolizumab单药治疗的比较效果尚不清楚。
在黑色素瘤和其他恶性肿瘤中,还评估了Urelumab联合nivolumab的疗效。无论PD-L1的状态如何,联合治疗在黑色素瘤中获得了50%的最佳响应率,而在其他恶性肿瘤中疗效并不显著。
CD3靶向双特异性抗体另一个有趣的与CD137联合的可能性是CD3靶向双特异性抗体。除了CD3刺激提供的信号,CD137靶向双特异性抗体的共同刺激可提供持久的抗肿瘤反应。重要的是,CD3和CD137双特异性分子不必针对相同的TAA。在一个临床前小鼠模型中,靶向CD3/CEA和CD137L/FAP的双特异性分子的组合显示出协同抗肿瘤作用,相比CD3/CEA双特异性抗体的单独作用,联合应用伴随着肿瘤中CD8+T细胞的显著增加。最近,RO7122290与cibisatamab(CEA x CD3双特异性分子)和obinutuzumab联合应用于结直肠癌的Ib期研究已经启动(NCT04826003)。ADCC增强抗体
靶向CD137还可能增强ADCC活性依赖性单克隆抗体治疗的疗效,因为NK细胞的活化机制。在B细胞淋巴瘤患者中评估了Urelumab和利妥昔单抗联合治疗的效果,尽管其中许多药物暴露水平高于MTD,但仍观察到了响应。
此外,utomilumab联合利妥昔单抗治疗的非霍奇金淋巴瘤患者的ORR为21.2%。为了证实这一临床前假说,CD137激动剂是否能增强人体ADCC活性,PRS-343联合ramucirumab和紫杉醇治疗HER2阳性胃癌的临床研究正在启动。
4-1BB靶向治疗实体瘤的挑战
首先,有必要建立一个可转化的临床前模型,可以预测临床安全性和反应。除了癌症类型的免疫反应外,了解器官特异性免疫反应也很重要。此外,还有优化免疫细胞激活的方面,包括优化药物的分子大小,以穿透肿瘤并激活肿瘤环境中的T细胞,这是至关重要的。
然而,如果分子的大小足够小,那么其在循环系统中的持续时间可能不足以有效到达肿瘤。为了通过降低较小的双特异性分子的肾清除率来实现更好的药物递送,可以使用与白蛋白结合的形式。CB307和NM21-1480都使用HSA偶联的结构,目前正在I期临床试验中进行研究。另外,由于T细胞持续暴露于抗原可能导致T细胞衰竭,因此确定哪种治疗半衰期最合适尚不清楚。为了回答这个问题,可能需要对多种给药方案进行临床研究。
临床试验中CD137靶向分子患者选择的优化也需要探索。CD137+TIL在多种实体瘤中的表达已在mRNA水平检测到,然而迄今为止,还没有基于CD137+TIL信息对CD137靶向药物进行的前瞻性临床试验。这是因为CD137表达的动态性使得很难获得确定的结果,事实上,没有数据表明对CD137单抗的反应与肿瘤微环境中CD137的表达水平相关。
对于PRS-343,在观察到CD8+T细胞扩增的剂量水平上可以看到临床反应,然而,CD8+T细胞扩增可能被证明是临床疗效的必要条件,但不是充分条件,因为即使观察到CD8+T细胞扩增,其他患者也没有看到临床反应。了解补偿途径,以最大限度地发挥T细胞的细胞毒活性,同时保持适当的安全边际将需要进一步的研究,以为成功的联合治疗铺平道路。
最后,CD137激活产生记忆T细胞的有效方法,可能是持久的抗癌免疫效果的关键,因为记忆T细胞不会耗竭。
小结
CD137作为一种免疫肿瘤靶点非常具有吸引力,并且根据现有的临床资料,它仍然是TNFRSF中T细胞共刺激受体中最有希望的靶点之一。目前对下一代CD137靶向分子的第一阶段研究致力于在不影响药效的前提下解决肝毒性问题。
了解CD137治疗患者的生物学特性以及选择患者以优化临床反应的策略对于CD137靶向药物的未来成功至关重要。CD137的双抗及其联合治疗将为肿瘤免疫治疗开辟一条新的道路。
参考文献:
1.CD137 as anAttractive T Cell Co-Stimulatory Target in the TNFRSF for Immuno-Oncology DrugDevelopment. Cancers 2021, 13, 2288.2. An Update onAnti-CD137 Antibodies in Immunotherapies for Cancer. Int J Mol Sci. 2019 Apr;20(8): 1822.

图片新闻
技术文库
最新活动更多
-
4月23日立即报名>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
4月25日立即报名>> 【线下论坛】新唐科技2025新品发布会
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论