ADC概论:ADC连接子及研究进展详述
连接子不仅是抗体与小分子有效载荷之间形成共价连接的分子部分,而且是靶向药物治疗中具有设计性质的关键元件。连接子的加入不应诱导聚集,并且需要确保可接受的PK特性,同时限制有效载荷在血浆中的过早释放(稳定性),并使活性分子在靶向作用位点有效释放。连接子分为两类:不可切割型和可切割型。
不可切割连接子
基于不可切割的连接子的ADC必须被内化,抗体部分需要被溶酶体蛋白酶降解以释放活性分子。在ADC开发过程中已经探索了许多不可切割的连接子,最具代表性的是N-琥珀酰亚胺基-4-(N-马来酰亚胺甲基)环己烷-1-羧酸盐(SMCC),Kadcyla就是使用的此类型连接子。

这种结构的分解代谢导致Lys-SMC-DM1成为主要的肿瘤代谢物。此外,与这种连接子相连的药物通常不能发挥旁观者效应,因为释放的分解代谢产物通透性较差。目前的研究主要集中在可切割的连接子上。
使用可切割连接子对于具内化和不具内化ADC的设计同样可行,因为释放是由切割位点(溶酶体和/或肿瘤环境)的性质触发的。连接子可以分为两大类:酶依赖性和化学(即非酶)依赖性。
化学依赖性连接子
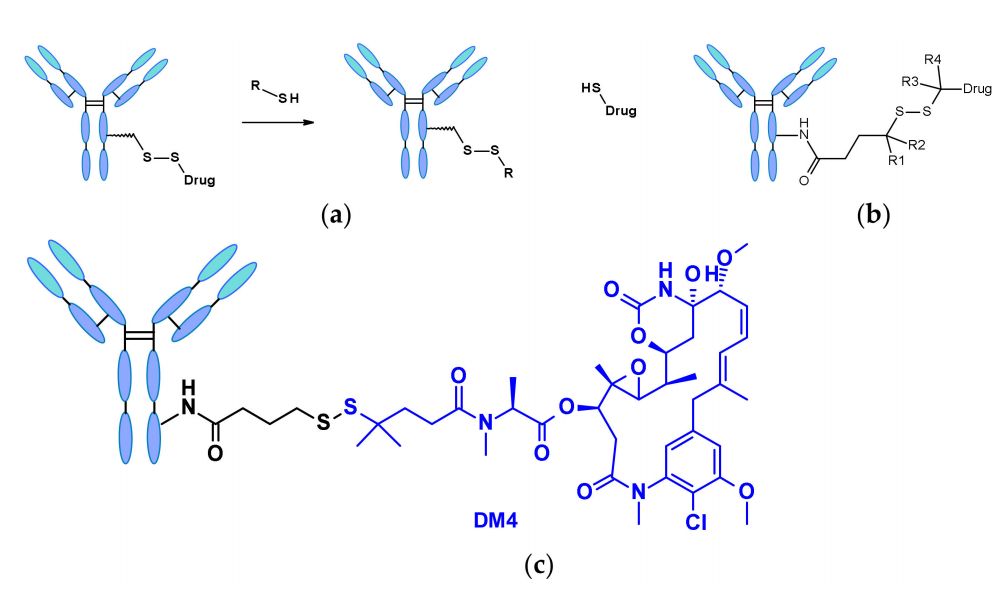
含有二硫键的连接子受到硫醇的亲核攻击以释放活性载荷。尽管血浆中人血清白蛋白(HSA)的还原形式就是最丰富的硫醇,但它对大分子的反应性很差。胞浆中还含有高水平的谷胱甘肽(GSH),这是一种含有巯基的三肽,很容易与S-亲核蛋白发生反应。血液(微摩尔范围)和细胞质(毫摩尔范围)中GSH浓度的差异以及癌细胞引起的氧化应激有助于药物在癌细胞内的优先释放。含有二硫键的连接子主要与maytansinoid类有效载荷相关。二硫键的反应性可由空间位阻调节:α-甲基替换显著影响还原速率和对硫醇-二硫键交换的抗性,如SAR-3419的连接子通过偕二甲基替换获得SPDB-DM4最佳的抗肿瘤活性。
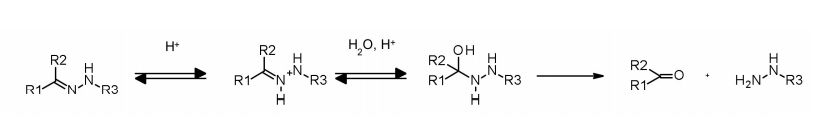
腙连接子显示出依赖于pH的稳定性,在中性pH下稳定,并在酸性介质中水解(内体的pH<6,溶酶体的pH<5),形成相应的酮和肼。
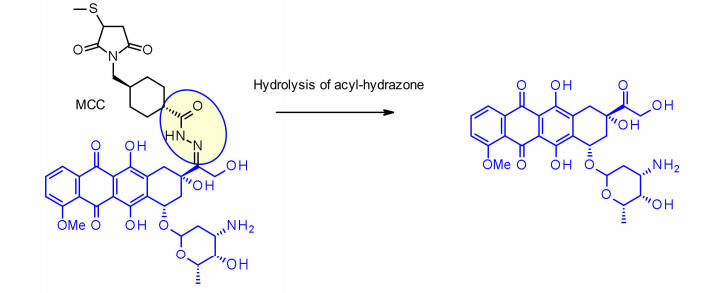
该方法已成功应用于IMMU-110,包含一个可裂解酰基腙连接子,由4-马来酰亚胺甲基环己烷-1-羧酸盐(MCC)的酰肼与阿霉素中存在的酮基反应中形成。
腙连接体也经常用于卡利霉素家族的有效载荷,在这种情况下,释放是由两步活化过程触发的:第一步酸敏感腙被水解,第二步二硫键被GSH还原,使巯基中间体环化。这种连接子已经在上市的Mylotarg和Besponsa中使用,但是它们在血浆中的稳定性不如预期,也不如其他可切割连接子吸引人。
酶依赖性连接子
为了限制有效载荷在内化前的释放,从而防止或最小化目标细胞外的降解,溶酶体的蛋白质组分成为寻找能够降解ADC并以高浓度存在的酶的合理场所。
组织蛋白酶-B
组织蛋白酶B是一种半胱氨酸蛋白酶,存在于哺乳动物的晚期内体和溶酶体中,在许多癌细胞中也过度表达。最初,一种可切割的二肽作为组织蛋白酶B的底物用作阿霉素前药,这项工作建立了SAR的二肽部分:P1位置需要亲水性残基(瓜氨酸或精氨酸),而P2位置的亲脂性残基增强血浆稳定性(苯丙氨酸、缬氨酸或丙氨酸)。
此外,还引入了一个自降解间隔子来促进酶的进入,从而限制了有效载荷的空间位阻:对氨基苄基氨基甲酸酯(PABA)在酸性介质中自发1,6-消除,释放二氧化碳、对氮杂醌甲酰胺和阿霉素。最终,这一发现从前药转移到ADC领域,证明了Val-Cit和Phe-Lys二肽连接子的抗原驱动的细胞活性。

Val-Cit二肽是ADCs中最常用的可裂解连接子,目前有多达25个分子处于临床阶段,可能是因为其整体良好的血浆稳定性、释放行为和化学可牵引性。两个已获批的ADC药物(Adcetris和Polivy) 都使用了相同的连接子mc-VC-PABC,其中包含马来酰亚胺基间隔子、作为组织蛋白酶底物的标准Val Cit二肽序列和PABC自降解间隔子。
Val-Ala二肽也被广泛应用,有7个分子处于临床阶段,进展最快的是Loncastuximab tesirine,其包括一个聚乙二醇化间隔子,以平衡属于PBD二聚体家族的有效载荷SG3199的亲脂性。

研究表明,由于沉淀和聚集,Val-Cit很难实现高DAR。相反,Val-Ala连接子允许DAR高达7.4,且聚集有限(<10%)。与Val-Cit相比,Val-Ala的疏水性较低,这解释了为什么这种连接子在亲脂性的有效载荷(如PBD二聚体)方面表现卓越,7个临床候选ADC的Val-Ala连接子都连接PBD。
一些研究将Val-Cit和Val-Ala二肽结构与MMAE的有效载荷连接进行了比较。在非内化抗体的情况下,结合到工程化半胱氨酸的Val-Cit和Val-Ala连接子都表现出类似的特征,并且比Val-Lys和Val-Arg类似物表现出更好的性能。在使用随机半胱氨酸结合的抗Her2 ADC的情况下,与Val-Cit相比,Val-Ala在高DAR结构中显示出较少的聚集性。另一方面,两种连接子显示出相似的缓冲稳定性、组织蛋白酶B释放效率、细胞活性和组织病理学特征。
四肽Gly-Gly-Phe-Gly显示出稳定和有效的可切割连接子的所有特性,已上市的ADC药物Enhertu使用了此类连接子。第一三共的Enhertu是一种血浆稳定的ADC,DAR为7.7,在溶酶体中发生蛋白酶降解,释放DX-8951f,这是一种有效的拓扑异构酶I抑制剂,来源于exatecan。由于连接子不含增溶剂,达到如此高的DAR是非常可观的,因为它与广泛确立的原理相矛盾,即高DAR结合物可能具有较差的药代动力学特征。这里使用的自降解间隔子是简单和紧凑的半胺化,而不是Val-Cit连接子使用的PABC。

磷酸酶和焦磷酸酶
与组织蛋白酶一样,焦磷酸酶和磷酸酶也是在溶酶体中选择性表达的水解酶。2016年,默克公司的研究人员设计了含有磷酸和焦磷酸的连接子与组织蛋白酶B敏感的Val-Cit-PABA搭配,旨在传递糖皮质激素:磷酸盐/焦磷酸盐部分结合在自降解间隔子PABA和有效载荷之间。内化后,有效载荷可通过组织蛋白酶B、自降解间隔子和磷酸酶(n=1)的顺序释放。对于焦磷酸酯(n=2),可能需要另一个涉及焦磷酸酶的步骤。
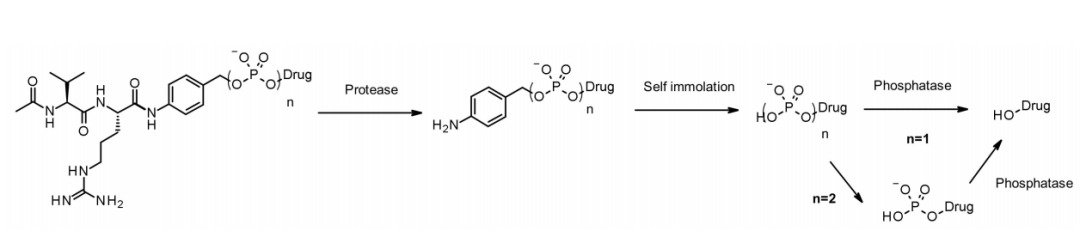
这种亲水性和永久性带电基团的优点是溶解性,不仅能够与亲脂性糖皮质激素衍生物进行生物偶联,而且促进ADC纯化, ADC中的残余连接子少于0.10%。含有磷酸和焦磷酸的ADC在体外都具有活性。
默克公司的同一组研究人员还开发了一种独特的基于焦磷酸酶的连接子,用于释放含羟基有效载荷地塞米松和丙酸氟替卡松。
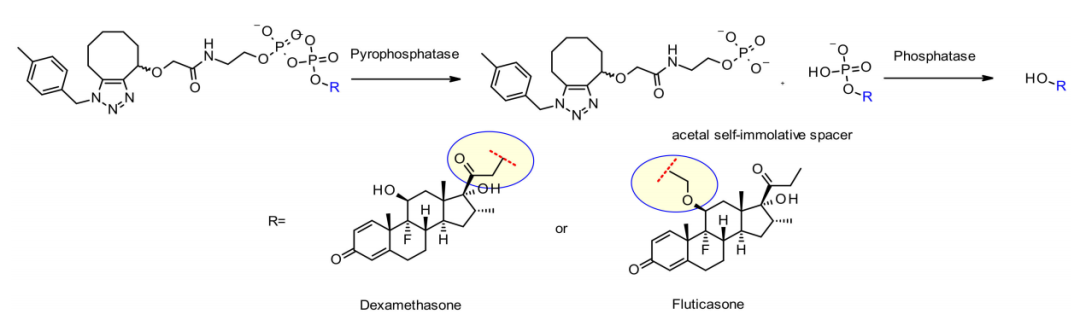
此外,羟基附着点的性质对有效释放至关重要。地塞米松的伯醇效果良好,而更受阻的氟替卡松的仲醇需要一个缩醛间隔子,从而实现可接受的释放。两种ADC在体外均表现出良好的稳定性,对肿瘤细胞系具有较强的活性。
β-葡萄糖醛酸酶
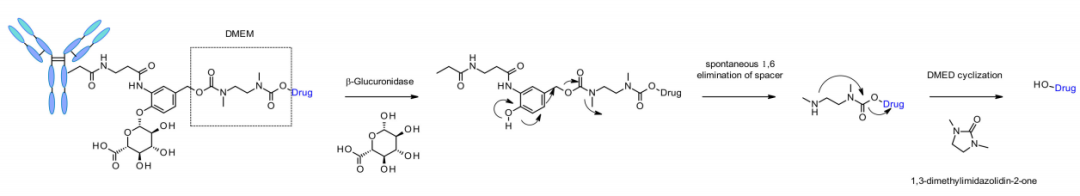
β-葡萄糖醛酸酶是一类糖苷酶,催化β-葡萄糖醛酸残基的水解,它在溶酶体和肿瘤间质中高表达。西雅图遗传学的研究人员于2006年发表了一项开创性的工作,抗CD70 ADC使用了含葡萄糖醛酸的连接子,葡萄糖醛酸附着在自降解间隔子上。这种连接子表现出低水平的聚集、高血浆稳定性、以及强大的体内功效。

该连接子还通过一个额外的二甲基乙二胺(DMED)自降解间隔子应用于其他含胺的有效载荷,如喜树碱类似物、SN38、杜卡霉素和苦参碱。释放顺序从水解β-葡萄糖醛酸到自降解间隔子,DMED的另一个环化反应自发发生,形成1,3-二甲基咪唑啉-2-酮,并最终释放含羟基药物。由于连接子的亲水性,与组织蛋白酶敏感连接子相比,该技术使ADC的DAR=8制备更为容易。
β-半乳糖苷酶
最近报道了一种使用β-半乳糖苷酶裂解连接子的ADC,其中包含PEG10间隔子。间隔子被硝基取代,以提高自降解速率。类比β-葡萄糖醛酸酶连接子,其解离机制涉及水解β-半乳糖苷酶部分,它赋予化学前体亲水性。另一个优势是β-半乳糖苷酶仅存在于溶酶体中,而β-葡萄糖醛酸酶在溶酶体中表达,也在实体瘤的微环境中表达。研究证明,在抗HER2-ADCs释放MMAE的背景下,含β-半乳糖苷酶连接子的 ADC在体外和体内均比T-DM1更为有效。

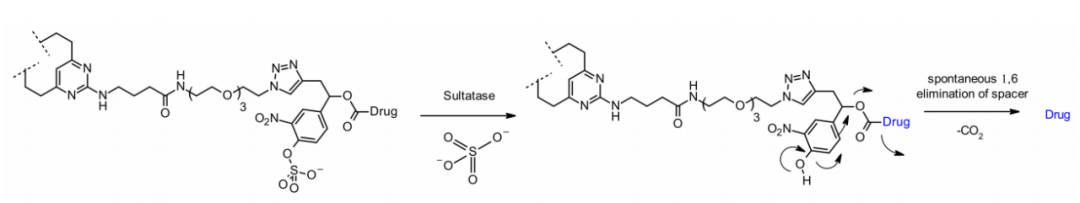
硫酸酯酶
最近,出现了硫酸酯酶裂解的连接子,硫酸酯酶在几种癌症类型中过度表达,表现出潜在的选择性。研究涉及以MMAE为有效载荷的抗Her2抗体,与经典的可切割Val-Cit和Val-Ala连接子相比,硫酸酯酶连接子对Her2+细胞系显示出相似的效力。
参考文献:
1.The Chemistry Behind ADCs. Pharmaceuticals (Basel). 2021 May; 14(5): 442.

图片新闻
技术文库
最新活动更多
-
4月23日立即报名>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
4月25日立即报名>> 【线下论坛】新唐科技2025新品发布会
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论