肿瘤免疫:肿瘤领域演化中的临床终点
前言
目前,已有多个肿瘤领域的临床终点被用于寻求监管部门的批准,包括总生存期(OS)、无进展生存期(PFS)和客观响应率(ORR)。与五年生存期、一年生存期、完全缓解期(CR)和缓解持续时间(DoR)一起,这些都属于传统上用于肿瘤临床试验的终点,并且被认为具有确定的价值。
基于OS获益批准的产品包括用于结直肠癌的encorafenib和用于膀胱癌的avelumab。基于PFS获益批准的治疗方法包括治疗转移性非小细胞肺癌的ramucirumab和治疗胃肠道间质瘤的ripretinib;基于ORR批准的包括sacituzumab治疗转移性三阴性乳腺癌和selpercatinib治疗非小细胞肺癌。
近年来,随着科学技术的进步,新药物在缩小肿瘤大小和延缓肿瘤生长方面取得了显著进步,这使得它们倾向使用更多演化的替代终点,以支持传统的和加速的肿瘤药物批准。对2016年至2020年间结直肠癌、多发性骨髓瘤、非小细胞肺癌、尿路上皮癌和前列腺癌临床试验的传统终点和替代终点的分析表明,最常见的替代主要终点是病理完全应答(pCR)、复发率(RR)、无病生存期(DFS),实体瘤的无事件生存期(EFS)和疾病控制率(DCR),多发性骨髓瘤的微小残留病灶(MRD)。两个最广泛使用的替代终点,DCR和RR,多用于转移性疾病的一二线治疗,而pCR和DFS是佐剂/新佐剂研究中最常用的主要终点。
尽管不断发展的临床终点已被用于监管部门的批准,但支付方之间仍然存在相互矛盾的意见。Apalutamide获得了基于替代终点的批准,但HTA的评估表明,支付方对此类替代终点的接受程度有限。而pembrolizumab把pCR数据作为主要终点,而OS和EFS数据不成熟(临床试验中未达到有效期)时,FDA肿瘤药物咨询委员会(ODAC)一致决定推迟FDA对这些适应症中pembrolizumab的批准。
当强有力的研究数据表明这些变化可以预测临床结果时,替代终点可能是最有用的。它使所有利益相关者能够有效地评估药物的益处,同时确保向需要药物的患者迅速提供治疗。这些终点应该持续监测,以了解它们在治疗中是如何演变的,以及在适当的情况下考虑新的演化替代终点以允许快速批准药物。
肿瘤学临床终点的定义
癌症护理的重大进展源于预防、早期发现、药物治疗和其他治疗方式的进展。为了衡量这些改善,肿瘤领域临床试验可以选择一些不同的主要和/或次要终点来衡量治疗的益处。“金标准”传统上是中位总生存期,越来越多的人也接受其他传统使用的终点,包括PFS和ORR。

随着个体寿命的延长和生存期的延长,药物可能无法改善这些常用的终点。传统的终点往往需要大量的样本和漫长的评估时间,这可能会扼杀创新和限制新疗法的可用性。因此,在目前传统终点有限的情况下,可能需要转向其他终点来衡量收益。
传统FDA对肿瘤治疗的批准需要良好控制的临床试验来证明其有效性和安全性,而加速批准还需要基于替代终点的安全性和有效性的大量证据。虽然加速批准允许更多地使用不断演变的替代终点以更早地获得治疗,但必须证明该产品优于现有的治疗方法,并且赞助商必须完成上市后的试验,以确认有意义的临床益处。
替代终点的趋势
在监管机构批准的最常用终点中,那些包含生存期的终点是证明临床益处的金标准。然而,生存期分析需要大量的样本,并且可能需要数年的长期随访来测量中位总生存期,有效的进展后治疗也可能会混淆或降低生存期。这种局限性是在肿瘤领域临床上使用替代终点的主要动机。基于流行病学、治疗学、病理生理学或其他科学证据,替代终点有望预测临床益处。此外,替代终点的使用已广泛应用于临床试验。1992年至2019年间,美国FDA为132种基于替代终点的药物颁发了194种独特的肿瘤药物授权。
使用替代终点的类似趋势也出现在欧盟市场授权机构(MAAs)中。临床试验中最常报告的(主要或次要)终点是OS(94%)、PFS(93%)和ORR(87%)。在所有应用中,OS、PFS和ORR分别构成MAA的主要终点的34%、49%和22%和次要终点的60%、44%和66%。值得注意的是,OS累计作为所有肿瘤适应症的主要终点显著下降(平均下降近13%),同时OS作为次要终点的比率增加,这对于血液学适应症尤其明显。
上述数据表明,在美国和欧盟,替代终点正越来越多地被用于评估肿瘤治疗。然而,这些替代终点并非没有缺点,例如OS的次优正预测值,导致一些国家(如德国)的支付方持怀疑态度。
临床终点的优缺点
FPS经常被用作常规和加速/有条件批准的替代终点,仅需要有限的患者数量和较短的随访期。ORR也可以作为一个替代终点,与生存期相比,可以在更短的时间内测量临床益处。

持久的ORR有益于患者,因为它意味着对治疗的长期响应,但这也可能导致一些独特的监管问题,如:
1.前所未有的高ORR和响应持续时间如何适应当前的审批模式?
2.什么时候不需要对照组的随机试验,什么时候需要进一步跟进现实世界的证据?
此外,ORR/CR与FPS/OS之间的关联强度在不同研究之间差异很大,因此很难确定一致的模式。使用替代终点要求支付方推断和估计对患者的真正益处,这导致经济价值的不确定性,更加复杂的是,替代终点不一定能为产品的综合效益风险预测提供与最终结果相同的结果。吉非替尼证明了这个问题,这项技术最初被许可用于非小细胞肺癌,但后来发现在总体生存率方面没有任何益处,许可证随后受到限制。这样的例子使得德国的支付方对替代终点能够提供重要结论的信心降低。
肿瘤学替代终点的评价
在进行中的临床试验中确定了25个正在演变的终点,作为II期和III期的主要终点。病理完全缓解率、复发率、无病生存期、无事件生存期和疾病控制率是2016年至2020年临床试验中最常见的主要替代终点。微小残留病灶是多发性骨髓瘤最常见的演变主要终点。
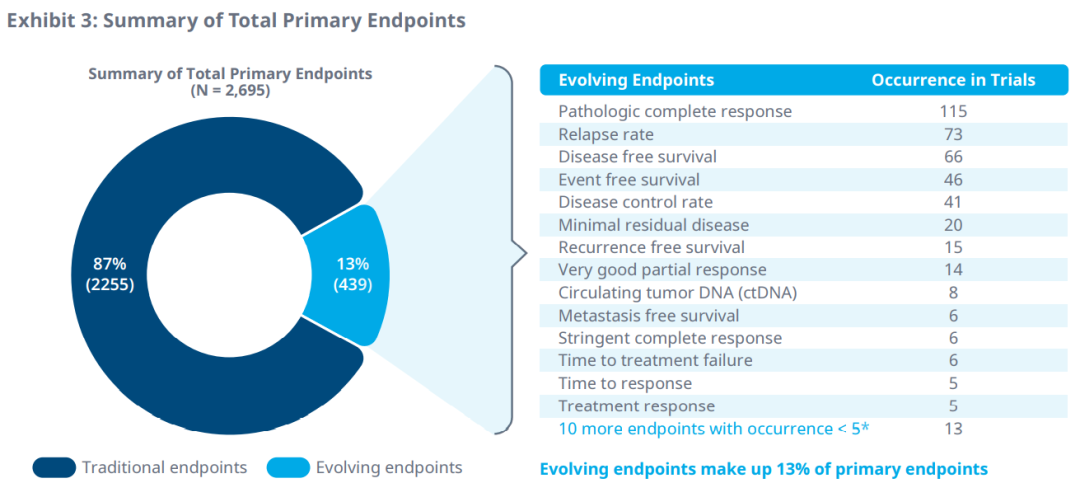
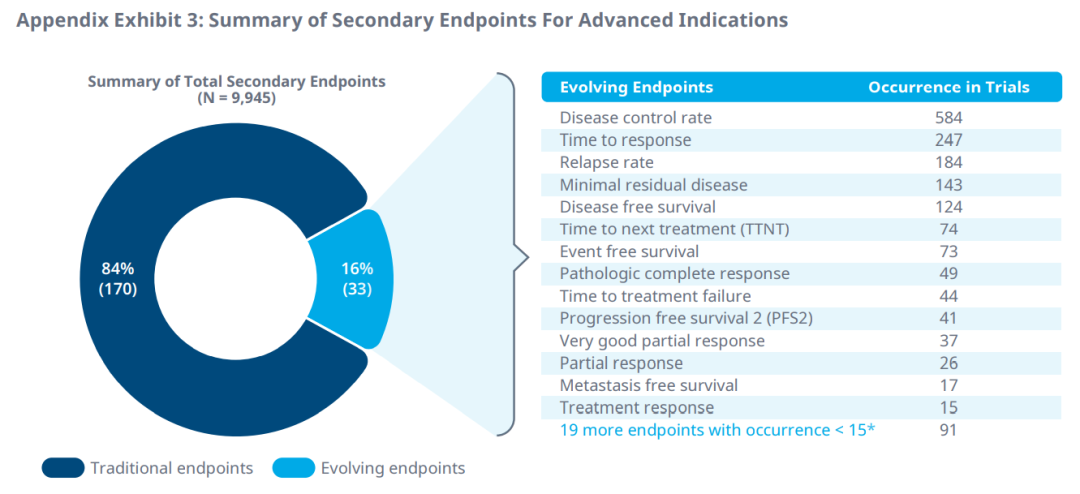
此外,在51个肿瘤适应症的II期和III期试验中,33个替代终点被确定为次要终点。疾病控制率、响应时间、无病生存期、复发率和病理完全响应是2016年至2020年临床试验中最常见的次要终点。微小残留病灶也是多发性骨髓瘤最常见的次要终点。

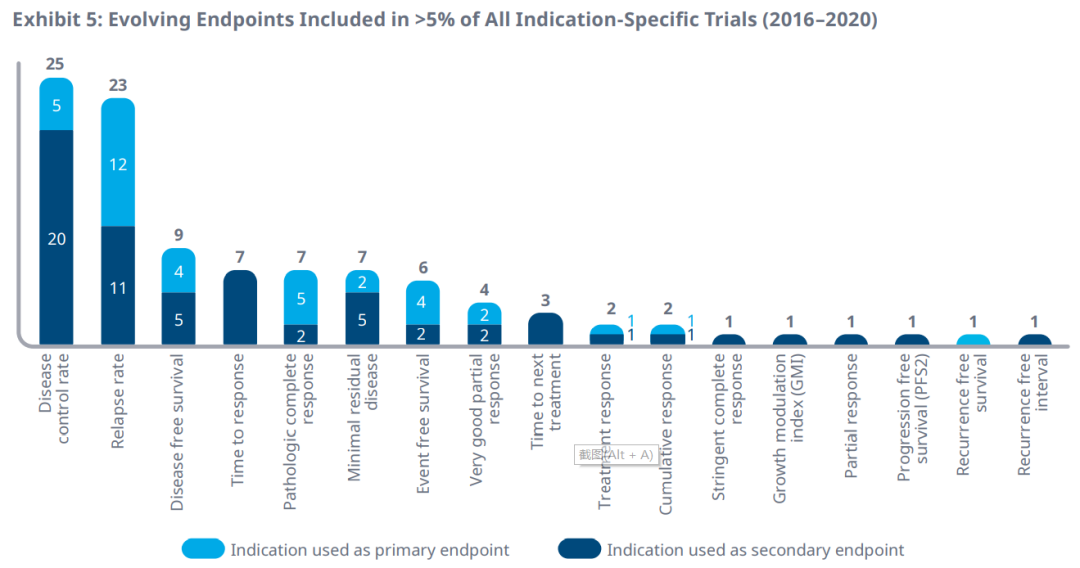
在2016年至2020年期间,有17个替代终点在超过5%的特定适应症的临床试验中被选为主要终点或次要终点。疾病控制率和复发率被分别用于25个和23个适应症的临床试验终点。
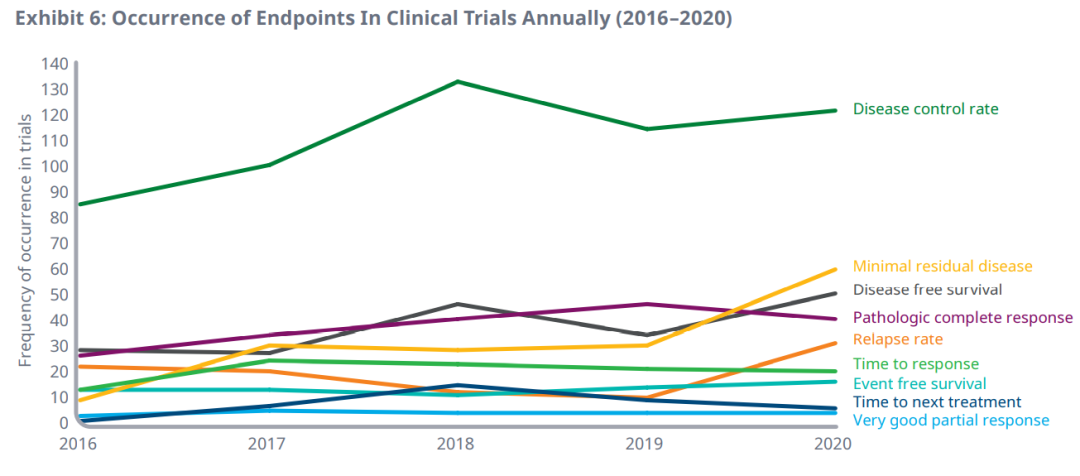
其中前9个替代终点,2016年至2020年临床试验中的年发生率如下图。相比于2016年,最小残留病(555%)、无病生存期(78%)、病理完全应答率(53%)和疾病控制率(43%)在2020年临床试验中的年使用量增加最多。
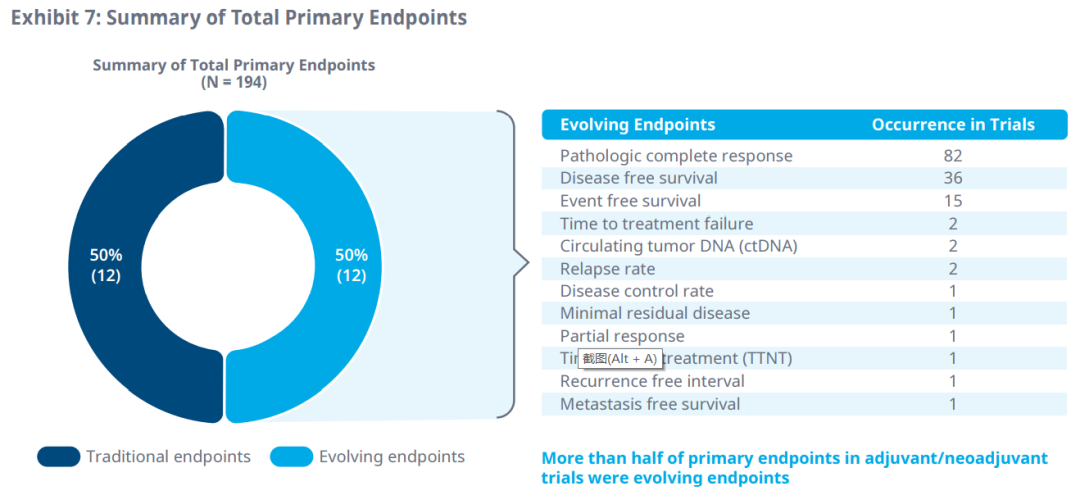
病理完全响应和无病生存期是辅助/新辅助治疗中最常用的替代终点,作为主要和次要终点。

在晚期癌症的临床试验中,疾病控制率、复发率和响应时间是最常用的主要和次要终点。
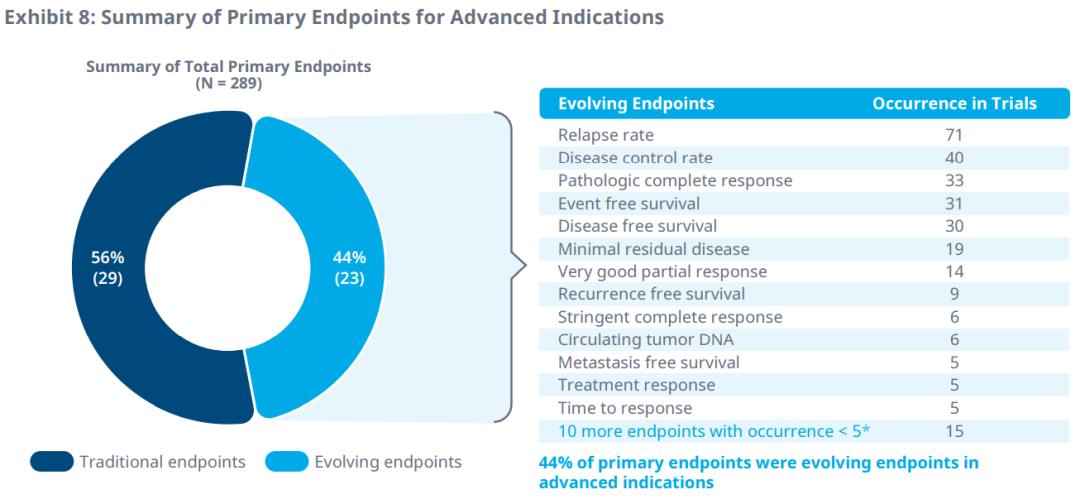
DFS被认为是辅助/新辅助治疗中预后良好(总生存期>18个月)以及生存数据不成熟时的合适疗效替代终点。pCR是另一个演化中的终点,适用于术前辅助/新辅助治疗或化疗,而对于具有转移指征和良好预后的治疗,DCR可能是PFS和不成熟OS数据的合适支持替代终点。
替代终点的未来应用
当可靠的验证研究表明特定替代终点的变化可以预测生存结果的变化时,这个替代终点是最有用的。随着这些替代终点的不断发展,正确的设计和应用对于未来药物的获批将是非常重要的。
在肿瘤领域的临床试验中,这些不断发展的替代终点应该持续监测,进一步的试验和研究需要显示替代终点和长期生存期之间的明确联系,以便使各方都能接受。业界、监管者和支付方都需要继续思考如何在正确的时间为正确的患者提供最佳的服务,从新的角度看待这些替代终点可以让所有利益相关者有效地评估药物的益处,同时确保治疗能够迅速地提供给需要的患者。
参考文献:
Evolving Oncology Endpoints: A New Horizonfor Oncology Outcomes. 2021 IQVIA

图片新闻
技术文库
最新活动更多
-
4月23日立即报名>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
4月25日立即报名>> 【线下论坛】新唐科技2025新品发布会
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论