AAV基因治疗中的中和抗体
前言
基因治疗是目前最火热的治疗领域之一,因为它针对的是疾病的潜在致病原因而不仅仅是症状。目前,我们在基因治疗开发方面取得了巨大进展,在可用的基因治疗平台中,基于腺相关病毒(AAV)的载体显然已成为最有希望的基因传递载体之一。
腺相关病毒在基因治疗方面的发展势头越来越大,越来越多的临床试验将其用于各种治疗。事实上,截至目前监管机构只批准了三种体内基因治疗方法用于临床,这三种疗法都是基于AAV载体的。2012年,欧洲药品管理局(EMA)首次批准使用AAV载体治疗脂蛋白脂肪酶缺乏症,但由于需求不足,目前已不再上市。此外,FDA批准的基于AAV的基因疗法包括Sparktherapeutics的Luxturna和Avexis的药物Zolgensma,分别用于治疗遗传性视网膜疾病和脊髓性肌萎缩症。AAV因其较低的免疫原性和位点特异性整合能力被认为具有更好的安全性。然而,抗AAV的中和抗体在大多数人群中普遍存在,这限制了AAV的系统应用。
AAV的历史与病毒学
AAV最早发现于20世纪60年代,被认为是腺病毒培养的污染物。然而,随着发现AAV只有在腺病毒存在下才能复制,以及后来的单纯疱疹病毒1型(HSV-1)的存在,腺病毒和AAV之间的联系很快建立起来。在确定AAV可以转化哺乳动物细胞后,研究人员开始生产重组AAV(rAAV)。含有腺病毒DNA的质粒可以独立于辅助病毒复制AAV。这一发现推动了该领域的发展,并真正开启了AAV的基因治疗领域。
AAV是一种小的、无包膜的细小病毒,在20-25nm的衣壳中基因组大小为?4.7kbp。基因组分为复制(REP)和衣壳蛋白质(CAP)的两个编码区,基因组两端都有反向重复序列(ITR)。REP编码与感染、整合和复制有关的四种蛋白质,Rep40、Rep52、Rep68和Rep78,而CAP编码三种蛋白,VP1,VP2和VP3,它们分别以1:1:10的比例组成AAV的60-mer衣壳。VP3是最丰富的,构成了外壳结构的外部,而VP1和VP2构成内部。

AAV不能独立复制,只有在辅助病毒(如腺病毒、单纯疱疹病毒、痘苗病毒)存在时,才能进行复制和溶细胞性感染,否则只能建立溶源性潜伏感染。AAV将其基因组整合到19号染色体上的一个特定位置,即AAVS1,或在染色体外独立复制。AAV是非致病性的,即使在其自然状态下也不会引起任何疾病;此外,它没有系统的固有性免疫反应。总共发现了12种天然的AAV衣壳血清型,并命名为AAV1-AAV12,它们显示出优先与体内特定组织结合的特性。
AAV不仅能感染活跃分裂的细胞,而且能感染静止的细胞,这使得它对许多病毒和非病毒载体对基因传递不敏感的细胞群特别有价值,例如视网膜细胞和神经元细胞。AAV感染静止细胞的自然能力促进了基因治疗的许多显著进步,例如FDA批准的治疗Leber先天性黑朦的Luxturna(Spark Therapeutics)。
临床上批准的基于AAV的基因治疗药物
在过去的20年中,基于AAV载体的基于治疗在临床转化中的相关性不断提高,目前占全球基因治疗临床试验的8.1%。
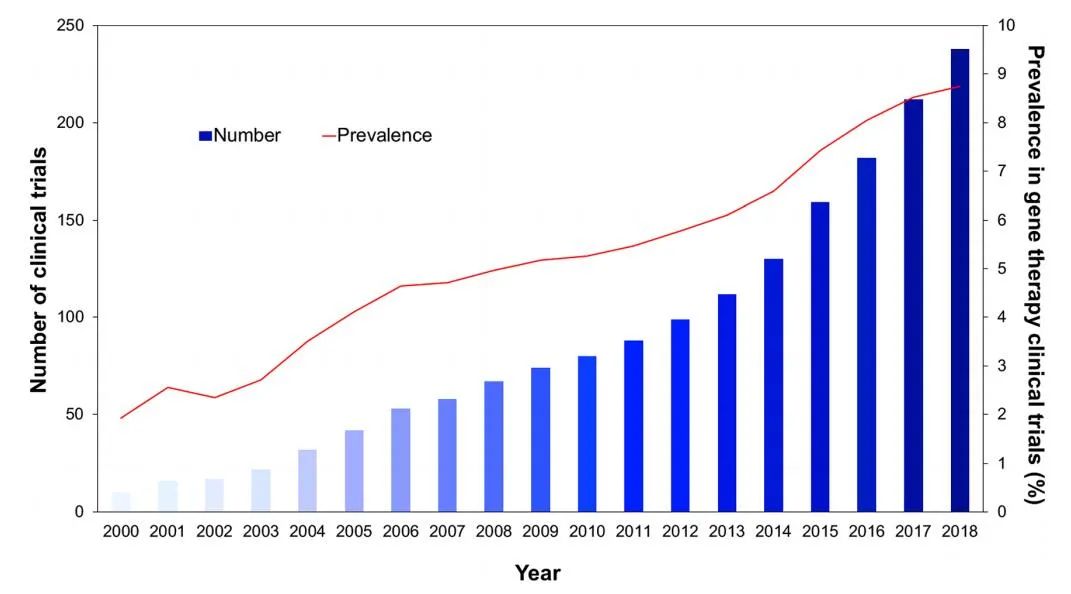
第一个批准在欧洲临床使用的基于AAV的基因治疗药物是alipogene tiparvovec(AT),用于治疗脂蛋白脂酶缺乏症(LPLD),这是一种罕见的常染色体隐性疾病。该药物于2012年获得批准,商品名为Glybera。AT基因疗法提供LPL基因的变体,LPLS447X,以纠正LPL患者LPL的功能。在III期临床试验中,给药AT后14周,低脂饮食后乳糜微粒的峰值水平降低了79%。
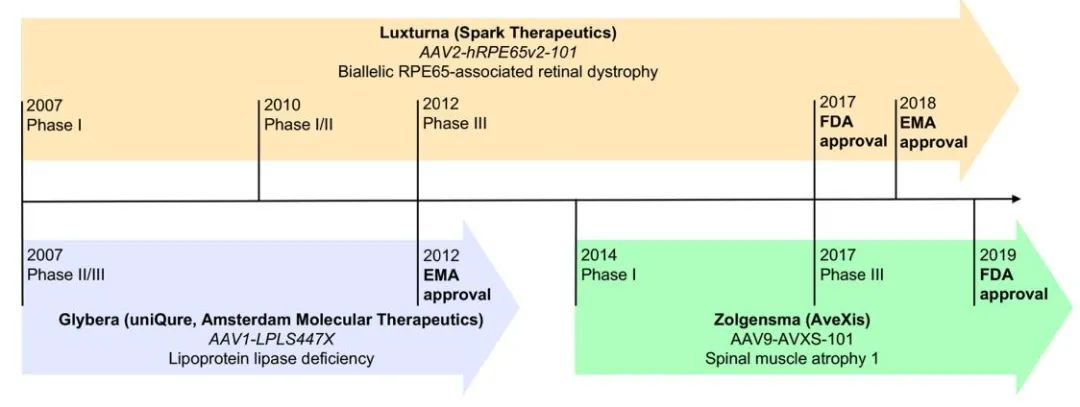
目前有17种美国FDA批准的基因疗法,包括AAV载体voretigene neparvovec rzyl(VN),由Spark Therapeutics于2017年开发,商品名为Luxturna。VN包含一个包裹RPE6基因的AAV2,用于治疗双等位基因RPE65相关的视网膜营养不良症,一种罕见的遗传性疾病,导致视功能受损,随年龄增长而下降,最终导致失明。在2012年进行的III期临床试验中(NCT00999609),Leber先天性黑朦2型患者接受视网膜下注射VN 1年后,65%的参与者获得最大改善。在VN获批之前,还没有治疗视网膜营养不良的药物。
2019年获得FDA批准的第二种基于AAV的基因疗法是Onasemogene abeparvovec xioi(OA),由AveXis开发,商品名为Zolgensma。OA利用表达功能性SMN1转基因的AAV9治疗2岁以下儿童的I型脊髓性肌萎缩症(SMA1)。SMA1的特点是脑干和脊髓的运动神经元丢失,导致运动功能严重受损,并最终因呼吸衰竭死亡。它是导致婴儿死亡的最常见单基因遗传性疾病。在2017年一项名为STR1VE的三期临床试验中(NCT03306277),接受治疗后, 91%的患者在14个月时仍无需永久性呼吸支持,50%的患者在18个月时能够独立静坐。
AAV应用的挑战
大多数成功的用于临床前和临床研究的AAV仅限于天然的衣壳血清型,但这些AAV血清型在临床上的广泛应用存在明显的局限性。抗AAV的中和抗体的存在仍然是全身输送的一个重要障碍,这些中和抗体干扰AAV进入靶细胞、细胞内运输和细胞核内的解包装,从而阻止了转导。为了更好地了解接触AAV所产生的免疫反应,已经进行了一些研究,检查了产生的IgG亚类,发现它们主要是IgG1。流行病学研究表明,在30-60%的人群中可发现血清阳性率不同的中和抗体。这些中和抗体中最流行的是针对AAV2的,其次是AAV1。
AAV介导的基因治疗的另一个问题是基因组(4.7kbp)的大小限制,包括ITRs,给转入的基因只留下一个?4.5kbp的大小空间,这将其靶向适应症缩小到只能是那些小片段转基因的表达。
克服中和抗体的解决方案
工程化AAV
AAV可以通过衣壳修饰、表面偶联和封装进行设计,以解决天然AAV的局限性。理论上,克服已有NAB挑战的最吸引人的方法是将突变引入AAV衣壳,从而阻止NAB的结合。已经证明将点突变引入AAV2衣壳可以减弱这些突变病毒对中和抗体的敏感性。然而,这些位点中的许多对AAV的转导是必不可少的,因此在不损害其功能的前提下对其进行修饰具有挑战性。
对于大多数病毒,也包括AAV,在所有针对病毒的中和抗体中,很大一部分是针对受体结合域的。因此,受体结合域的突变可能是改善中和的最佳方法,但受体结合域的突变也很可能影响病毒的导向性和转导效率。
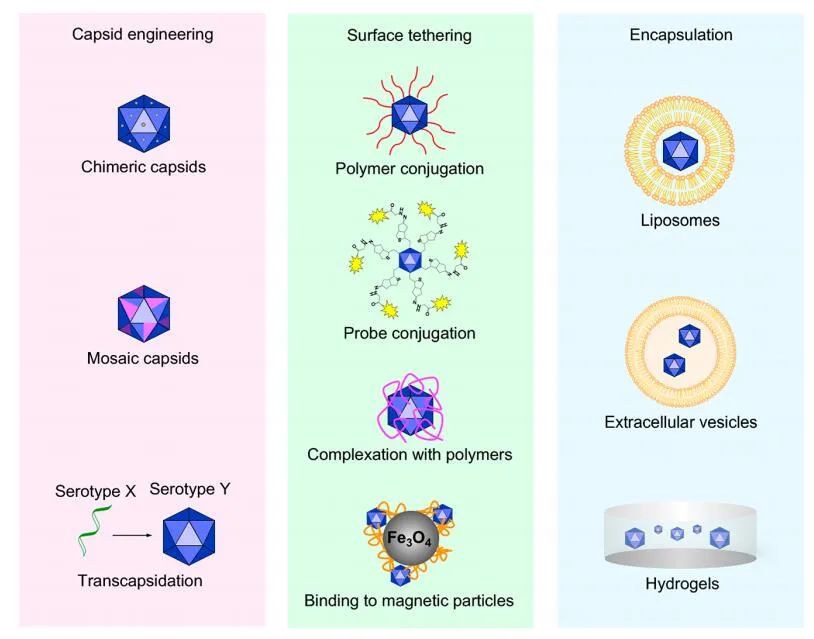
此外,使用聚合物、脂类和水凝胶的表面栓系和包封都能够保护AAV衣壳免受nAbs的侵袭,使其能够逃避免疫系统的检测和抗体反应。
血浆置换
“传统”血浆置换术可以去除所有免疫球蛋白,在从患者血清中去除大多数NAb方面显示出一定的前景,尽管只适用于NAb滴度较低的患者。此外,去除所有免疫球蛋白也有其自身的缺点。最近,有研究已经证明,通过将IVIG或人血清与共价偶联AAV颗粒的珠子孵育,可以在体外去除中和抗体/因子。在NAb滴度较高的动物中,使用这种珠粒进行血采可以完全恢复肝转导,而在没有血采的动物中,肝转导几乎不存在。
最近,有研究利用了imlifidase(IdeS),一种链球菌胱氨酸蛋白酶,可以将IgG切割成F(ab')2片段和Fc。用IDE处理IVIG可在24小时的潜伏期后完全消化总IgG和抗AAV8IgG。
小结
已有的抗AAV中和抗体对于AAV基因治疗来说是一个棘手的问题,因为它们会严重限制可能受益于AAV基因治疗的患者群体。在过去几年中,在克服这一巨大障碍方面取得了重大进展,工程化的AAV可以解决这些问题,同时提供了额外的好处。此外,IgG裂解蛋白酶特别适合于使用已有抗AAV抗体的AAV基因治疗患者。
随着全球市场上临床认可产品的出现,以及越来越多正在进行的成功临床试验,AAV正处于基因治疗的前沿,进一步的技术进步还需要推进更多的临床试验来验证,但AAV已经在未来的基因治疗中展现出广阔的前景。
参考文献:
1.Anti-AAV Antibodies in AAV Gene Therapy:Current Challenges and Possible Solutions. Front Immunol. 2021; 12: 658399.
2. Synthetically Engineered Adeno-Associated Virus for Efficient,Safe, and Versatile Gene Therapy Applications. ACS Nano. 2020 Oct 19.

图片新闻
技术文库
最新活动更多
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> 【线下论坛】新唐科技2025新品发布会
-
精彩回顾立即查看>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论