CRISPR/Cas9与过继性T细胞治疗
前言
近年来,过继性T细胞(ACT)免疫治疗在开拓和加速肿瘤治疗领域方面显示出了巨大的潜力,并在临床实践中取得了前所未有的突破。CRISPR-CAS9系统作为一种多用途的基因编辑技术,为有效地创新肿瘤研究和肿瘤治疗奠定了坚实的基础。CRISPR/Cas9与肿瘤过继性T细胞免疫治疗这两项肿瘤研究和治疗革命性技术的结合,可能进一步拓宽免疫治疗在更多肿瘤患者中的应用。
CRISPR/CAS9系统
CRISPR/Cas9系统本质上是一种针对外源DNA的细菌防御机制。CRISPR最初发现于20世纪80年代末,是一种由交替重复和非重复DNA序列组成的不寻常的遗传结构。基因组分析表明,CRISPR和Cas蛋白作为获得性免疫系统发挥作用,并通过RNA引导的DNA切割系统保护原核DNA免受噬菌体和质粒DNA的攻击。
当外源DNA侵入细菌时,其DNA片段作为间隔子并入CRISPR位点。然后将该位点转录到CRISPR前RNA(crRNA),该RNA附着到组成性形成的反式激活RNA(tracrRNA)上,由CRISPR相关蛋白修饰成gRNA。当gRNA与非活性Cas9复合物的REC I结构域结合时,该复合物被激活,导致gRNA及其互补单链DNA形成异源双链。Cas9的HNH和RuvC核酸酶域随后分别切割互补和非互补DNA链。
Cas9属于1类CRISPR-Cas系统的II型,来源于化脓链球菌。Cas9与靶序列的偶联需要一个原间隔基邻近基序(PAM),一个小的入侵基因组中的3-8bp DNA序列,PAM在区分细菌自身和非自身DNA以及成功结合Cas9方面至关重要。
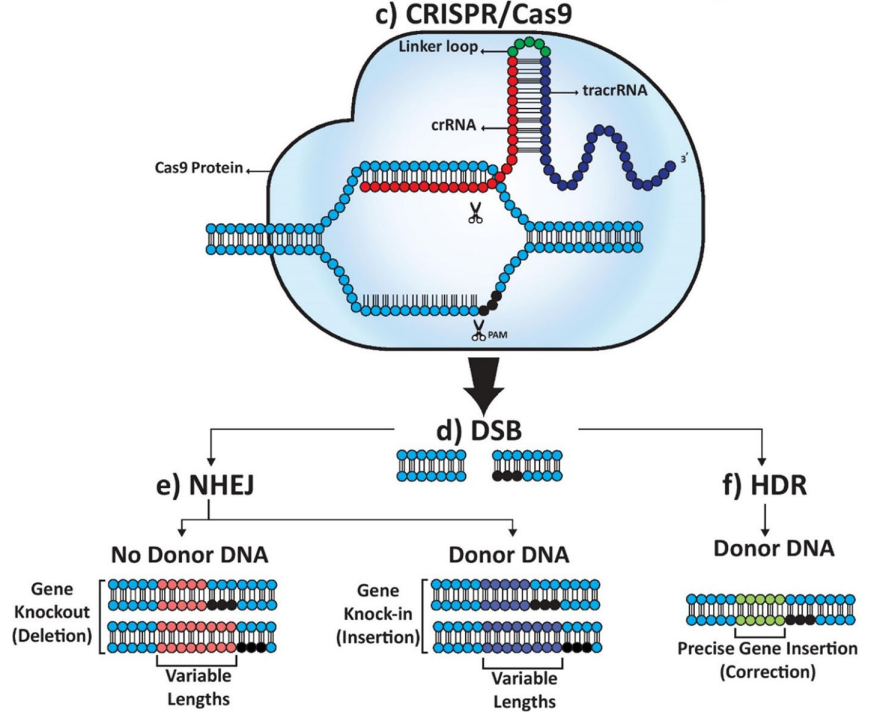
与ZFN和TALEN不同,ZFN和TALEN依赖于每个特定基因序列的精细蛋白质产物,CRISPR/Cas9系统依赖于gRNAs,使其成为更灵活的平台。Cas9蛋白保持不变,而gRNA可以方便地根据每个基因进行定制。CRISPR/Cas9系统的另一个优点是,它使得在多个基因座上同时进行基因编辑成为可能,与以前的系统相比,它提供了一个更高效和可扩展的平台。
CRISPR/CAS9在CAR-T治疗中的应用
目前,CAR-T细胞治疗已经在血液恶性肿瘤中显示出前所未有的疗效。然而尽管已经取得了令人印象深刻的临床结果,但由于多种原因,许多患者仍然无法从CAR-T细胞治疗中获益。首先,制造T细胞的个性化方法费时且昂贵,这阻碍了许多患者,尤其是疾病快速进展的患者充分利用这种免疫疗法;第二,在生产过程中,淋巴细胞减少的患者很难产生足够高质量的T细胞,即使患者获得足够的免疫细胞,这些细胞也可能无法完成整个制造过程;最后,自体CAR-T产品的异质性可能会导致不可预测和可变的临床结果。
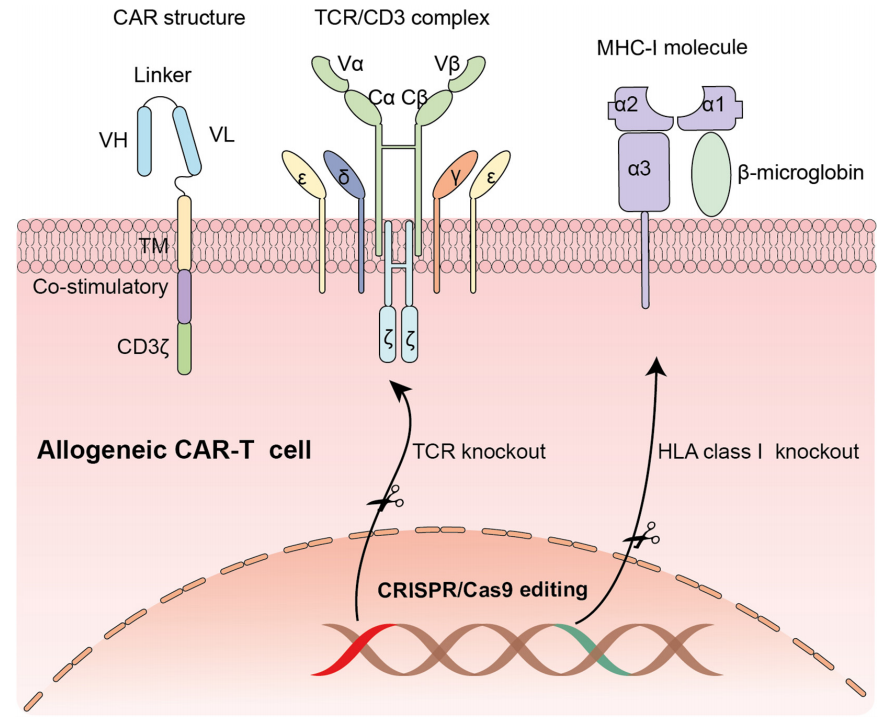
CRISPR/Cas9产生通用异基因CAR-T细胞
为了克服限制CAR-T细胞治疗广泛应用的障碍,人们提出了多种治疗策略。最可行和持久的方法之一是从健康捐赠者中产生异基因通用CAR-T细胞。与自体CAR-T细胞相比,“现成”的同种异体CAR-T细胞具有许多潜在优势,包括可立即为急需的患者提供冷冻保存的CAR-T细胞、首次输注或再给药的足够数量以及CAR-T细胞生产标准化。考虑到供者T淋巴细胞上存在内源性HLA和TCR,通用产品的最大挑战是同种异体反应和移植物抗宿主病(GVHD)的潜在风险。
随着基因编辑技术的进步,人们逐步实现了内源性TCR的根除。通过锌指核酸酶(ZFNs)和转录激活物样效应器核酸酶(TALENs),人们都制造出了敲除TCR的CAR-T细胞。然而,完全同种异体CAR-T细胞的产生需要同时敲除TCR和HLA分子并转导CAR,这需要一种更高效和精确的基因编辑技术来实现。
与ZFNs和TALENs相比,CRISPR/Cas9具有良好的柔性和高效性,在异基因CAR-T细胞的制备中有着广泛的应用。CRISPR/Cae9可以同时高效地敲除多个基因位点。Ren等人使用CRISPR/Cas9产生同时敲除内源性TCR、HLA-I和PD-1的CAR-T细胞,其在体外和动物模型中显示出强大的抗肿瘤活性。
CRISPR/Cas9削弱抑制性检查点分子
尽管在血液系统恶性肿瘤中取得了显著的成功,但由于免疫抑制性肿瘤微环境和T细胞衰竭,仍有许多患者的CAR-T细胞治疗不理想。由于共抑制分子(如PD-1、CTLA-4、LAG-3和TIM-3)在T细胞功能障碍中的重要作用,CRISPR/Cas9也被用于破坏这些抑制基因以增强CAR-T细胞功能。

CRISPR/Cas9促进T细胞细胞因子的产生
细胞因子在调节T细胞的功能中是必不可少的。TCR刺激的强度极大地影响细胞因子的分泌。结构性表达IL-12和IL-15的CAR-T细胞可以提高抗肿瘤活性和长期持久性。此外,已证明IL-18可促进IFN-γ的产生和CAR-T细胞增殖。因此,可以利用病毒转导人工诱导细胞因子的产生;然而,细胞因子过度表达可能导致T细胞耗竭或自身免疫。CRISPR/Cas9也可用于在特定位点敲入所需的细胞因子基因,并使其分泌受到内在启动子的严格控制。
二酰甘油激酶(DGK)是下调二酰甘油(DAG)的酶,DAG是下游TCR激活形成的第二信使,DGK的缺失可增强T细胞活性。研究证明了DGKA/DGKB-DKO抗EGFRvIII CAR-T细胞如何增加IFN-γ/IL-2的产生和体外细胞毒性以及诱导对TGF-β和前列腺素E2的抵抗。在胶质母细胞瘤异种移植小鼠模型中,这些CAR-T细胞在肿瘤消退方面也产生了有希望的结果。
CRISPR/CAS9在TCR-T细胞治疗中的应用
众所周知,CAR-T细胞在实体瘤中的作用有限。肿瘤特异性抗原缺乏、肿瘤抗原异质性和肿瘤微环境抑制是其主要原因。与CAR-T免疫疗法相比,工程化TCR-T细胞疗法在靶向更广泛的抗原方面具有更大的前景,从而扩大了治疗癌症的范围。
然而, TCR-T细胞治疗的主要问题之一是受体T细胞上存在内源性TCR。内源性TCRs与转基因TCRs竞争CD3的结合,此外,内源性TCR与转基因TCR的错配也可能导致混合TCR二聚体的形成。
为了解决这些问题,CRISPR/Cas9系统被用来把内源性TCR α和β 基因替换成具有人工肿瘤特异性TCR序列的基因。与传统的TCR-T细胞相比,敲除内源性TCR可提高转基因TCR的表达和功能。此外,动物模型中CRISPR/Cas9修饰T细胞的抗肿瘤反应增强。
为了减少错误配对的风险,另一个策略是替换成一个稳定的Vα/Vβ 单链TCR(Sc TCR)。据报道,通过CRISPR/Cas9转导Sc-TCRs几乎完全消除了TCR错配。2020年,CRISPR/Cas9编辑的TCR-T细胞首次在难治性癌症患者中进行了临床试验,对安全性和可行性进行评估。通过分离患者自体T细胞,慢病毒转导表达NY-ESO-1和LAGE-1特异性TCR,然后用CRISPR/Cas9破坏内源性TCRs和PD-1基因。CRISPR修饰的T细胞在体外扩增后回输3例患者。两名患者病情稳定,另一名患者病情进展。
CRISPR/CAS9在ACT治疗中的临床现状
在过去的十年中,许多临床试验已经启动,以评估ZFNs、TALENs和CRISPR基因编辑平台在多种疾病中的可行性、安全性和有效性,如β-地中海贫血、艾滋病、血友病B、粘多糖病(MPS)、镰状细胞贫血和多种恶性肿瘤。
ACT治疗癌症是最近基因编辑试验的主要焦点之一。中国人民解放军总医院的研究人员于2016年开始了第一次CRISPR人类I期临床试验(NCT02793856),该试验在IV期转移性非小细胞肺癌患者中评估PD-1-KO原代T细胞的安全性和疗效。但该研究显示出较低的非靶向效应,并且没有严重的治疗相关副作用,然而,这项研究的有效性并不明确,因为没有对治疗的临床疗效进行调查。同年,开始了另外三项I期临床试验,评估IV期膀胱癌(NCT02863913)、转移性肾细胞癌(NCT02867332)和激素难治性前列腺癌(NCT02867345)中的PD-1-KO原代T细胞,但所有这些试验后来都被撤回。
TIL和原代T细胞仅构成CRISPR介导的ACT试验的一小部分,大多数临床试验集中于CAR-T/TCR-T细胞。在一项开放性I期研究(NCT03398967)中,评估了CRISPR/Cas9工程化通用CD19/CD22 CAR-T细胞在6例复发/难治性急性淋巴细胞白血病患者中的安全性和有效性。研究显示,没有GVHD或基因编辑相关的不良反应,然而,所有患者均出现CRS。该疗法还显示出显著的抗肿瘤活性,83%的患者在输注28天后达到完全缓解。
此外,关于T细胞恶性肿瘤,基因编辑可用于消除CD7的表达,这种有吸引力的标记物在T细胞肿瘤中高度表达。Cooper等人设计了功能性UCART7,以在体外/体内消除T-ALL,同时避免GVHD风险;这已成为当前针对T细胞白血病或淋巴瘤患者的临床试验的基础(NCT03690011)。
削弱免疫检查点的CRISPR/Cas9也正在临床试验中进行研究。如通过CRISPR/Cas9破坏PD-1以产生间皮素导向的CAR-T细胞(NCT03747965)和UCART(NCT03545815)进行试验中。最近的一项临床试验正在研究在CD19-CAR-T细胞中使用经编辑的内源性造血祖细胞激酶1(HPK1)的疗效;HPK1是一种负性调节TCR激活信号的激酶,因此是一种新的免疫治疗靶点。
CRISPR/CAS9在ACT治疗中的挑战和局限性
尽管CRISPR/Cas9在提高免疫治疗效果方面显示出巨大的潜力,但与安全性和有效性相关的一些问题阻碍了其向临床应用的转化。
首先,以ACT为基础的肿瘤免疫治疗,包括CAR-T细胞、TCR-T细胞和TILs治疗,其临床疗效依赖于足够的T细胞。然而,大多数用于临床试验的CRISPR工程化T细胞通过电穿孔进行转导,这可能导致细胞损伤并阻碍T细胞体外增殖。因此,病毒载体等更安全、更高效的传递途径亟待探索。
此外,cas9蛋白的免疫原性可能是限制CRISPR/cas9临床转化的另一个挑战。78%和58%的捐赠者中检测到抗SaCas9和抗SpCas9抗体,这表明人对Cas9蛋白具有预先存在的适应性免疫应答,在CRISPR/Cas9治疗患者时可能引起不良反应。
第二,尽管已经报道了各种方法来改进gRNA设计,并增加了Cas酶的特异性,然而由于非特异性而导致的靶外效应风险仍然是将CRISPR/Cas9临床应用转化的主要障碍。虽然目前在临床试验中,没有明显的或只有少量的脱靶位点、染色体重排或缺失,但仍需要更多患者的经验和更长时间的随访来进一步验证其安全性和可行性。
小结
CRISPR/Cas9是新世纪最重要的发现之一,它将彻底改变世界,治疗和消除疾病只是其前景之一。得益于CRISPR,基因治疗正在迅速发展。ACT在对抗癌症方面是一种革命性的方法,然而自推出以来,它一直面临着许多障碍,如对实体瘤疗效有限、T细胞耗竭和功能丧失、异基因T细胞相关GVHD和制造成本等。
多功能的CRISPR平台虽然并非完美,但有潜力克服ACT面临的这些障碍。通过利用CRISPR技术消除MHC和内源性TCR表达,与异基因T细胞治疗相关的潜在GVHD被最小化;CRISPR还可用于优化T细胞功能,并通过破坏免疫检查点蛋白减少耗竭;将更有效的治疗性T细胞转化为更低的细胞剂量、更低的毒性和更低的成本。虽然多数临床试验仍处于早期阶段,但随着越来越多的临床试验的开展,并且一些试验的初步结果已经证明了可行性和有效性,CRISPR/Cas9辅助ACT癌症治疗的前景值得期待。
参考文献:
1.CRISPR/Cas9 revitalizes adoptive T-celltherapy for cancer immunotherapy. J Exp Clin Cancer Res. 2021; 40: 269.
2. CRISPR/Cas9 Gene-Editing in Cancer Immunotherapy: Promoting the Present Revolution in Cancer Therapy and ExploringMore. Front Cell Dev Biol. 2021; 9: 674467.

图片新闻
技术文库
最新活动更多
-
4月23日立即报名>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
4月25日立即报名>> 【线下论坛】新唐科技2025新品发布会
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论