2021国产PD-1揭榜:铁打的恒瑞,失速的君实
好好做药,它仍拥有无限可能……
4月22日,随着恒瑞医药2021年年报公布,业内备受关注的国产四大PD—1之争短暂告一段落。
恒瑞医药延续去年风格,并未直接公布数据。亿欧大健康依据卡瑞利珠单抗(200mg)医保价格2928元/瓶、141.43万瓶的销售数据测算,2021年卡瑞利珠单抗销售额约为41.41亿元。收入虽同比小幅下降,依旧稳坐国产PD—1第一宝座。
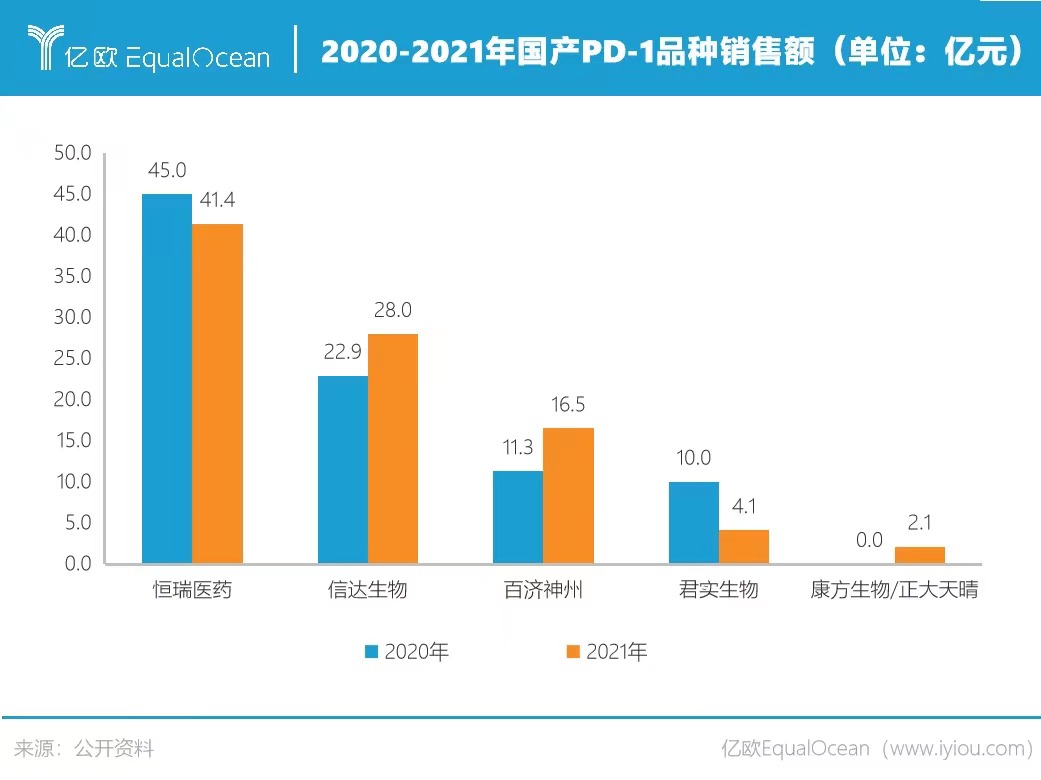
信达生物的信迪利单抗凭借最先进医保优势,表现也非常亮眼,销售收入及销量均保持强劲增长,去年收入约为28亿元。但出海折戟,也让信迪利单抗的海外销售之路增加了许多不确定性。
受益于医保报销范围扩大带来的新增患者需求、销售团队扩增以及药品进院数量增加,百济神州的替雷利珠单抗亦保持增长趋势。2021年替雷利珠单抗销售额约为16.5亿元,相比2020的销售收入,同比增幅超40%。
最令人意外的莫过于君实生物。特瑞普利单抗作为国内第一个上市的PD—1,理应享有先发优势,却在销售收入上节节败退。2021年君实生物PD-1收入锐减59%,仅为4.1亿元,呈断崖式下跌。要知道,康方生物/正大天晴的派安普利单抗于2021年8月5日获批上市,上市仅3个月就卖了2.12亿元。后来者气势汹汹,君实生物国产PD—1第一梯队的位置岌岌可危。
随着业绩陆续公布,不难看出券商们预测的千亿市场在医保国谈的“砍刀”之下,已然缩水至百亿。PD-1曾是被寄予厚望的明星靶点,如今俨然成了创新药的“练兵场”。安信证券研究报告指出,预计至2022年底,将陆续有16款PD-1/PD-L1单抗在国内上市,竞争愈发白热化。
从2021年国产PD-1四大天王的成绩单中,能给创新药企什么启发?PD-1们出海之战进展如何?
适应证之争
适应证一直是PD-1的命门,业内素来有“得大适应证者得天下”的论断。
据西南证券测算,国内PD-1单抗总体市场规模有望达到305亿元。其中非鳞非小细胞肺癌、胃癌(her2阴性) 、肝癌、鳞状非小细胞肺癌合计市占率超过70%。因此药企想要在PD-1单抗百亿市场中分一杯羹,大适应证的布局必不可少。
恒瑞医药的卡瑞利珠单抗销售额遥遥领先,其一就是适应证广泛且涵盖大适应证。
随着注射用治疗二线及以上鼻咽癌、一线鼻咽癌、一线鳞状非小细胞肺癌、一线鳞状食管鳞癌的4个新适应证相继获批,卡瑞利珠单抗获批适应证总数达8个,是目前获批适应证最多的国产PD-1。但其在2021年医保谈判中,表现略逊一筹,新增的鼻咽癌两项适应证并未成功纳入医保目录,有被其他对手超越的风险。

纵览四大国产PD-1医保目录内适应证,不难发现肝癌、非鳞状非小细胞肺癌等大癌种,恒瑞医药、百济神州、信达均有布局。除了发力大癌种,在2021年底的医保谈判中,各家更是铆足了劲儿扩充医保目录内适应证。
百济神州的替雷利珠单抗与信达的信迪利单抗分别携三项新适应证华丽亮相2021年医保目录,君实生物的特瑞普利单抗也不甘人后,新增“三线鼻咽癌+二线尿路上皮癌”2项适应证。
事实上,在适应证的选择上,也极为考验药企决策层的智慧。选择大适应证,市场前景虽好,但免不了在红海市场“贴身肉搏”。选择小的适应症,可以短暂回避与大品种的正面交锋,快速开启上市通道。但适用人群较窄,不可避免的影响药企收入。
去年销售收入严重掉队的君实,正是吃了“小适应证”的亏。2018年12月,君实拿下首个国产PD-1单抗(特瑞普利单抗)上市名额,获批用于晚期黑色素瘤治疗。在当时,这一策略被理解为“从小适应症切入,再转向大适应证,避开主流大品种市场的正面交锋”。
黑色素瘤在中国并不是一个高发癌种,北京大学肿瘤医院斯璐教授曾公开指出,我国黑色素瘤发病率仅为0.8/10万,低于浅色族群人。瞄准小适应证之后,特瑞普利单抗因降价幅度较少,遗憾错过2019年底的国家医保目录谈判的“顺风车”。而信迪利单抗降幅超60%,拿到了医保目录的门票,信达生物也成为当年PD-1中唯一中选企业。
遗憾错失一年机会之后,即使君实以超60%降幅的行动将特瑞普利单抗送入2020年医保目录,但仅有黑色素瘤这一小适应证导致其2021年并未出现“以价换量”的效果。要知道,在晚期肿瘤治疗领域,医生对于超适应证用药仍有诸多顾虑。大而全的适应证或是助推PD-1成为现金奶牛的重要因素。
不过,随着三线及以后鼻咽癌、二线及以后尿路上皮癌适应症纳入到医保支付范围之内,君实生物的特瑞普利单抗销售或将回暖。
商业化之路动荡迭起
就算PD-1适应证多、产品好、最终还要看能不能“卖得好”。
对于国产PD-1四小龙商业化而言,2021年无疑是个多事之秋:进医保存在诸多意外、团队商业化负责人几经变动、裁员等问题,限制了商业化发挥。
即便销售团队强如恒瑞,卡瑞利珠单抗销售收入依然同比下降。在2021年报中,恒瑞坦言“国家医保谈判产品价格降幅较大,例如主要产品卡瑞利珠单抗价格降幅达 85%。”自2021年3月1日起,卡瑞利珠单抗执行2020版国家医保目录价格,加上产品进院难、各地医保执行时间不一等诸多情况,造成其销售量上涨,收入却同比下降。
君实生物的特瑞普利单抗则以近乎腰斩的收入,再现PD—1赛道的激烈战况。其全年销售收入仅为4.12 亿元,这一数字仅相当于后来者康方生物/正大天晴的派安普利单抗卖6个月的收入。
“君实面临最大的挑战,还是商业化体系的建设。”董事长熊俊在2021年报沟通会上的话更是印证了其PD-1的销售短板。无论是为特瑞普利单抗设立首席商务官,还是与阿斯利康牵手推广,最终结果都不尽如人意。
从2018年10月开始,君实生物先后挖来韩净、段鑫、钱巍三人,任职首席商务官,负责PD—1的商业化。三人均有多年的跨国药企销售经验,然而铁打的PD—1,流水的首席商务官,钱巍更是履职不足5个月便离职,于2022年2月重新回到老东家罗氏制药的怀抱。
于外,与阿斯利康短暂牵手,效果甚微。频繁的团队更迭、横生波折的外界合作让外界对特瑞普利单抗的商业化多了几分审视。以上种种,在年度报表汇成一句“2021 年亦是公司商业化团队较为动荡的一年。”
国内PD-1竞争日趋白热化,某种程度上而言,拥有一支懂进院、学术营销、医保谈判的商业化团队至关重要。从销售团队来看,截至2021年底,君实拥有销售人员846人,远低于恒瑞的“万人军”与信达生物、百济神州的“千人团”。
实现销售量与收入双增长的信达生物,正是在销售人员与渠道上发力。至2021年底,信达共有销售及市场推广2768名,占公司总人数的一半,商业化渠道覆盖范围已拓展至320多个城市的约5100家医院及1100间DTP药房。建立自己的“销售铁军”,或成为PD-1的制胜之道之一。
出海速度PK:谁能夺得首张FDA门票?
从诞生之初,PD—1们就已布局国内、与海外两个市场。国内市场规模日渐萎缩,而在布局已久的海外市场,PD—1们或将迎来自己的“甜蜜期”。
FDA曾公开表示,除了信迪利单抗,当前至少有25个主要基于中国临床试验和数据的肿瘤开发项目,申请计划提交、或正在进行FDA审查。药物出海已蔚然成风。

由于国内药企缺乏在国外注册上市以及商业化的经验,往往选择与跨国药企牵手以求更好推进全球市场,诸如礼来和信达合作推进PD—1、君实生物与 Coherus BioSciences、百济神州与诺华等。将海外市场商业化权益出售给更熟悉准入规则、销售网络成熟的跨国药企,似乎成为国产PD-1的最优解。
先行者信达生物、君实生物、百济神州、康方生物等已相继向FDA提交了PD-1抗体药物的BLA(生物制品执照申请),也将于今年陆续等待FDA的“审判”。
2月11日,在中国医药人员的“不眠夜”,ODAC最终以14:1的投票结果建议拒绝批准信迪利单抗,FDA也于3月正式拒绝信达生物的BLA。
在这场被称为“出海教科书”的会议中,专家组认为ORIENT-11是单一中国人群临床研究得到的数据,不符合国际多中心临床试验的要求,也不适用于美国患者人群和美国医疗实践。他们建议信迪利单抗应当以总生存期(OS)为临床终点,且应该把已批准的PD-1疗法作为对照组进行头对头试验。
从这场会议中,不难看出FDA正在收紧对国产PD-1们的审批标准。信迪利单抗之后,国产PD—1的后浪们能否成功拿到FDA的门票?君实生物的特瑞普利单抗将于本月揭晓谜底。
在业内人士看来,特瑞普利单抗成功的概率极高。首先,其鼻咽癌适应证已获得FDA的突破性疗法认定,为美国市场提供了未满足的医疗需求。其次,君实生物鼻咽癌一线3期临床试验为国际多中心研究,符合FDA要求。
“目前为止,特瑞普利单抗出海没有产生意料外问题,反馈正向。”2021年君实生物年报交流会纪要透露到,该PD—1远程生产、GCP(药物临床试验质量管理规范)核查已圆满完成。
如果获批,特瑞普利单抗将有望在美国实现销售,也将逐步打开全球市场销售的大门,扭转往日颓势。值得一提的是,手握多项FDA认定的特瑞普利单抗,或成为第一个在美国上市的国产 PD-1 产品。
与特瑞普利单抗共同瞄准鼻咽癌的派安普利单抗,亦在今年上半年闯关FDA,其申请适应证为三线治疗转移性鼻咽癌。由于FDA暂时没有批准过任何肿瘤免疫疗法作为鼻咽癌的治疗选择,所以康方生物的派安普利单抗已经获得了FDA授予突破性疗法认定和快速审批通道资格。不过,胜负仍未可知。
“烧钱小能手”百济神州有成功出海经验加持,替雷利珠单抗成功出海概率极高。
2021年9月,FDA受理了替雷利珠单抗的新药上市申请,用于治疗既往经系统治疗后不可切除、复发性局部晚期或转移性食管鳞状细胞癌患者。此项上市申请是基于一项随机、开放性、多中心的全球3期临床试验。试验主要终点是意向性治疗人群的总生存期(OS),共有512例来自亚洲、欧洲和北美的11个国家或地区的患者入组试验。
从试验主要终点及患者人群多样性来看,替雷利珠单抗似乎初步满足FDA要求。据美国《处方药使用者付费法案》,7月12日,替雷利珠单抗上市申请将由FDA一锤落定。
国产PD—1们征战海外市场,正以燎原之势重塑行业态势。在过往的2021年,重金押注PD—1的企业们,有人赚得盆满钵满,有人于迷雾、困顿中,寻得方向。结局未定,PD—1作为百年难得一遇的明星靶点,虽遭遇残酷的红海竞争,但其用亮眼的收入来证明——好好做药,它仍拥有无限可能……
本文来源于亿欧网,原创文章,作者:肖伞伞。作者:肖伞伞
原文标题 : 2021国产PD-1揭榜:铁打的恒瑞,失速的君实

图片新闻
技术文库
最新活动更多
-
4月23日立即报名>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
4月25日立即报名>> 【线下论坛】新唐科技2025新品发布会
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论