阿尔茨海默病的免疫治疗研究进展
前言
阿尔茨海默病(AD)是一种异质性神经退行性疾病,是老年痴呆症最常见的原因。AD在全球范围内发病率不断上升,目前仍然没有任何有效的治愈方法。此外,老龄化被认为是AD最关键的风险因素,因为它对免疫系统有相当大的影响。
最近的研究表明,免疫系统和中枢神经系统之间存在着错综复杂的联系,这种联系可能会失衡,从而介导神经炎症和AD。因此,针对AD的主动和被动免疫疗法可能重新平衡AD患者的免疫系统,以达到治疗AD的最终目标。
AD的病理学假说
AD的特征是由神经炎斑块和神经纤维缠结(NFTs)形成的β淀粉样蛋白的(Aβ)积聚。与AD相关的神经病理学变化包括因脑内沉积物积累而导致的阳性病理学变化,和因神经和突触丧失而导致萎缩的阴性病理学变化。AD的标志性病理蛋白包括Aβ和病理性tau,它们是AD发病的潜在生物标志物。研究表明,淀粉样蛋白异常沉积可导致认知能力迅速下降、进行性萎缩和代谢低下。
Tau病理学是AD发病机制的另一个促成因素。tau蛋白的基本功能是促进神经网络中微管和微管蛋白的相互作用和稳定性。然而,在AD中,tau突变可能会抑制这些重要功能。小胶质细胞、Aβ和tau在神经炎斑块的形成中似乎相互关联,其中Aβ和小胶质细胞之间的反应导致tau积累。导致AD进展的病理性tau蛋白主要形成错误折叠、聚集和过度磷酸化形式,它们以朊病毒样的方式扩散到整个大脑,过度磷酸化的tau蛋白会在轴突和树突内形成神经纤维缠结,导致神经元丢失。随着时间的推移,由于靶向tau的激酶或磷酸酶的改变,导致tau的毒性增强,从而抑制和沉默更多神经元。
此外,遗传学可以影响AD的发病风险。APOE基因的变体包括ε2、ε3和ε4等位基因,其中APOEε4亚型是一个重要的遗传风险因素,对AD的发展有重大不利影响。与非ε4携带者相比,APOEε4与AD发病年龄较低和发病率较高相关。
免疫细胞在脑稳态中的作用
在脑软组织中,可以发现小胶质细胞,数量有限但意义重大的NK细胞、B细胞、T细胞和树突状细胞。各种研究已经确定,CD4+T细胞在保持幼稚小鼠行为和认知能力方面具有重要作用。在稳态条件下,TH1(产生IFN-γ)和TH2(产生IL-4)CD4+T细胞都会在脑膜中生长。IFN-γ通过调节脑膜树突状细胞和刺激星形胶质细胞的BDNF表达,协助用于社会行为的关键神经回路。因此,T细胞及其分泌的细胞因子在维持脑内稳态过程中具有关键作用。
脉络丛是在脑室内发现的一种上皮组织。脉络丛形成血-脑脊液屏障,通过向脑脊液中分泌神经营养因子、参与aβ清除和转运白细胞,在维持脑内稳态方面发挥着关键作用。在观察幼稚小鼠时,发现脉络丛的基质含有大脑中超过50%的CD4+和CD8+T细胞。大多数这些T细胞具有效应记忆表型,包括TH1、TH2和Tregs,并具有识别中枢神经系统抗原的能力。研究发现,衰老会导致脉络丛显示出扭曲的TH1与TH2平衡比率,导致CCL11趋化因子表达增加,IL-4和IFN-γ对脉络丛上皮细胞的影响导致白细胞通透性降低,并阻碍认知。
AD与免疫系统
在AD病理学中,对大脑的观察可以发现小胶质细胞分化为一种与神经退行性疾病相关的新形式,包括改变的分子表达谱以及受限的吞噬能力。髓系细胞-2上表达的触发受体(TREM2)的异常变体也被观察到可将AD模型发病率至少提高两倍。此外,除了中枢神经系统内的上调外,TREM2 mRNA和蛋白在AD患者的外周白细胞中也显示出高表达,这与海马萎缩和认知缺陷有关。
中性粒细胞是人类外周血中最丰富的髓系细胞。中性粒细胞在先天免疫系统中具有关键作用,存在于5xFAD和3xTg AD小鼠的脑实质中。在这些小鼠的脑实质中,发现中性粒细胞似乎促进了认知能力下降、淀粉样斑块和tau缠结。然而,进一步的研究表明,用TNF-α调节药物治疗3xTg AD小鼠10个月后,中性粒细胞对大脑的浸润增加,同时淀粉样蛋白和tau病理学降低,记忆力增强。因此,有必要进一步研究阐明AD发病机制中浸润性中性粒细胞的特征。
在适应性免疫方面,过去的二十年里,B细胞产生Aβ抗体的现象已经被广泛研究。迄今为止,已发现抗Aβ抗体在人体血液中以不同的水平循环,这使人们考虑将B细胞介导的免疫反应作为一种治疗策略,因为研究表明,aβ免疫有可能阻止PDAPP小鼠淀粉样斑块的进展以及胶质增生和神经炎性营养不良。然而,正如AN1792临床人体试验所证明的那样,约6%的受试者患脑炎导致试验终止。尽管如此,有被动免疫治疗显示出不同的结果,大量临床试验仍在继续。
AD的免疫治疗
主动免疫疗法
1999年,人们利用PDAPP小鼠模型进行了首次主动Aβ免疫治疗研究,将全长人类Aβ肽和佐剂注射到年轻和老年的PDAPP鼠体内。在年轻的PDAPP小鼠中,免疫产生的Aβ抗体可完全阻止斑块形成和神经炎性营养不良,而在年长的PDAPP小鼠中,淀粉样沉积的程度显著降低。根据PDAPP小鼠的模型,AN-1792是第一个人类Aβ主动免疫疗法,由合成全长人类Aβ42和佐剂组成。
AN-1792的1期临床研究包括372名轻度至中度AD患者。第1阶段试验的结果表明,该疫苗可诱导对Aβ42的抗体反应,并可清除大脑中的斑块。然而,在II期试验中,由于患者发展为脑膜炎,临床试验暂停。尽管AN-1792临床试验有副作用,但该研究的结果鼓励开发新的主动抗Aβ免疫治疗方法。目前,CAD106、ABVac40、ACI-24和UB-311是II期试验中的活性抗Aβ疫苗。其他有效的抗Aβ免疫疗法包括肽疫苗V950、Vanutidecridificar(ACC-001)和Lu AF20513。

CAD106疫苗由诺华公司研发,通过诱导抗体产生来减少β淀粉样斑块。该疫苗由截短的β-淀粉样蛋白片段(Aβ1-6)组成,以避免T细胞活化。在第一阶段试验的52周内没有出现脑膜炎的迹象。目前,疫苗正在进行安全性试验,同时在第二阶段试验期间测量疫苗对β-淀粉样斑块的抗体反应。
ABvac40疫苗由AraclonBiotech开发,其结构针对Aβ40的C末端。该疫苗由Aβ40的短C末端片段和氢氧化铝佐剂组成。在第一阶段试验期间,招募了轻度至中度AD患者,测试疫苗的安全性、免疫原性和耐受性。截至目前,ABvac40已进入第二阶段试验,该研究预计将于2022年12月结束。
ACI-24疫苗由AC Immune开发,包含Aβ1-15表位,不包括T细胞表位,以避免T细胞反应。在转基因小鼠的临床前试验中,获得了认知能力的改善和Aβ的降低。目前,ACI-24正在进行二期试验,以测试轻度AD患者注射的安全性、免疫原性和耐受性。
UB-311疫苗由UnitedBiomedical开发,含有Aβ1-14表位,并与辅助T细胞肽表位连接。肽混合物将诱导B细胞反应,同时避免T细胞的炎症反应。在I期试验期间,轻度至中度AD患者产生了Aβ抗体反应,且疫苗是安全的和可耐受的。目前正在第二阶段试验期间,主要目标是收集关于安全性和免疫原性的进一步数据。
正在研究但已终止的Aβ免疫疗法包括肽疫苗V950、ACC-001和LUAF20513。肽疫苗V950由与ISCOMATORIX结合的Aβ1-14组成。然而在试验期间,该研究被终止,目前还没有任何临床数据。疫苗ACC-001由Aβ1-7组成,在第二阶段试验期间,发现该疫苗是安全的,患者耐受性良好。然而,患者体内没有发现任何改善,导致研究终止。LU AF20513疫苗由Aβ1-12重复序列组成,在第一阶段试验期间,由于缺乏疗效,该研究被终止。
被动免疫疗法
在被动免疫治疗中,抗体在体外产生,并直接注射到患者体内。抗Aβ的特异性单克隆抗体在PDAPP小鼠模型中首次证明了针对AD的被动免疫治疗效果。在6个月的过程中,发现小鼠的Aβ水平降低,而Fc受体介导的Aβ吞噬作用增加。随后,人们开发了多种抗Aβ抗体,包括bapineuzumab、gantenerumab、crenezumab,solanezumab和aducanumab,以及BAN 20401。
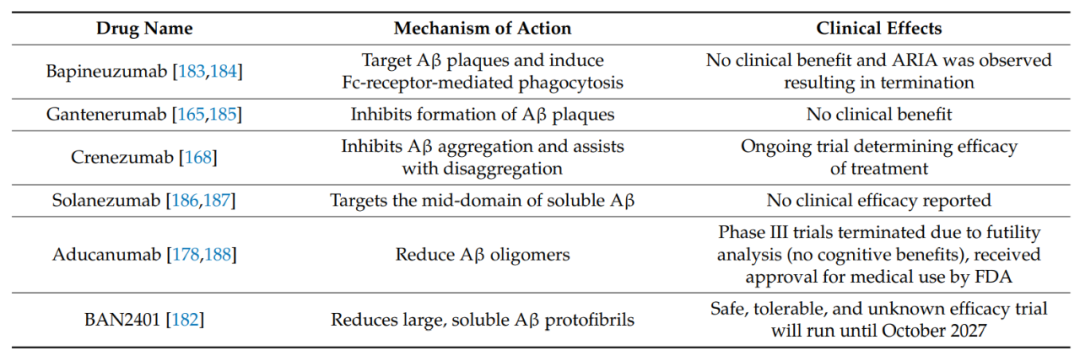
Bapineuzumab是第一种针对Aβ斑块并诱导Fc受体介导吞噬作用的人源化抗体。在第一阶段和第二阶段试验中,结果表明,对不携带APOEε4基因的患者来说,认知方面有益处,并且确立了总体安全性和耐受性。这促使bapineuzumab进入III期试验。然而,发现对认知和淀粉样蛋白相关成像异常(ARIA)的体征没有明显的治疗效果,导致研究终止。
Gantenerumab是一种人源抗体,与Aβ的N端具有亚毫摩尔水平的亲和力。该抗体已被证明通过与斑块结合后诱导吞噬作用的机制降低Aβ水平。在第1阶段试验期间,表明抗体是安全和可耐受的。随后在第二阶段和第三阶段进行了进一步研究,但认为总体无临床益处。
Crenezumab是一种人源化抗aβ抗体,可抑制aβ在单体、低聚物和纤维形式中的聚集,同时也有助于解聚过程。在第1阶段试验中,抗体表现出足够的安全性,没有副作用。在第二阶段临床试验采用更高浓度的抗体,观察到脑脊液中β-淀粉样蛋白的增加。然而,认知没有变化。对患者脑脊液(CSF)样本进行的低聚物Aβ超敏免疫分析发现,85%以上的患者CSF中低聚物Aβ水平降低,这表明治疗达到了大脑的预期目标。
Solanezumab是另一种针对可溶性Aβ的人源化单克隆抗体。在早期临床试验中,中度AD患者的认知没有改善。然而,轻度AD患者的恶化率有所降低。然而,2013年开始的第三阶段试验在治疗期间未能提供任何具有统计意义的结果。
Aducanumab是一种与聚集的Aβ结合的人源单克隆抗体。由于未达到主要目标,2019年3月,aducanumab的第三阶段研究暂停。然而,2019年10月,FDA再次开始审批aducanumab。2021年6月,FDA批准了aducanumab,但由于对治疗有效性的评估结果相互矛盾,围绕这一决定存在争议。标准的正常途径没有得到批准,但FDA选择了加速批准。人们对这一决定做出广泛的批评,涉及aducanumab是否有任何认知益处,或者它是否只会带来虚假的希望,因为它实际上不会阻止疾病的进展。目前,正在等待2030年结束的上市后试验,以证明该药物具有认知益处。
BAN2401靶向大的可溶性Aβ原纤维。在第1阶段试验期间,对安全性和耐受性进行了测试,轻度至中度AD患者没有ARIA报告。随后,在第二阶段试验中测试12个月的认知改善和安全性。然而结果显示,在12个月的时间段内没有认知益处。目前,一项为期4年的大型BAN2401研究正在进行中,以确定β淀粉样蛋白和认知功能的变化,该试验将持续到2027年10月。
小结
为了确保AD免疫治疗取得更大进展,必须考虑到AD是具有多种病理生物学和临床亚型的异质性多因素疾病。AD在脑萎缩和tau病理传播方面有主要的亚型,如轻度萎缩、典型的、边缘型为主的和海马保留型,但也有许多不同的变体,如轻度痴呆、皮质萎缩、皮质基底综合征、原发性进行性失语症、淀粉样蛋白阳性和免疫原性变体。除了AD的复杂性外,还存在与不同病理学和临床的交叉。因此,开发一种通用的AD药物可能性很小。因此,AD免疫治疗应侧重于精准和个性化的药物。
近年来,人们在成像和基因组工具的应用方面取得了重大进展,有助于识别精确分子途径的潜在遗传风险。此外,用于病理生理过程的检测技术也取得了显著进展。这使得在各种AD的临床试验中开始纳入了精准和个性化治疗,例如包括无症状AD的抗淀粉样蛋白研究、AD预防计划和显性遗传AD网络试验,这些研究的重点是具有公认AD风险因素的患者,以及神经成像和生物标记物,以帮助检测AD发病。未来,个性化和精准医学在AD中将可能产生新的治疗手段,为患者带来福音。
参考文献:
1.The Immune System as a Therapeutic Targetfor Alzheimer’s Disease. Life (Basel).2022 Sep; 12(9): 1440.
原文标题 : 阿尔茨海默病的免疫治疗研究进展

图片新闻
技术文库
最新活动更多
-
4月23日立即报名>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
4月25日立即报名>> 【线下论坛】新唐科技2025新品发布会
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论