靶向铁死亡的肿瘤免疫治疗
前言
铁死亡是最近发现的一种程序性细胞死亡,在肿瘤生物学和治疗中发挥着重要作用。这种独特的细胞死亡形式,以铁依赖性脂质过氧化为特征,由脂质、铁和氨基酸代谢等细胞代谢网络进行精确调节。
不同肿瘤对铁死亡的敏感性不同。最近的证据表明,三阴性乳腺癌(TNBC),这种治疗手段有限、高度侵袭性的疾病,特别容易受到铁死亡诱导物的影响,表明这种新形式的非凋亡性细胞死亡是治疗“难治”性肿瘤的一个有吸引力的靶点。
有趣的是,铁死亡最近被认为与T细胞介导的抗肿瘤免疫有关,并影响肿瘤免疫治疗的效果。因此,更好地理解这种铁依赖性的细胞死亡将有助于发现新的癌症联合治疗策略,具有重要的生物学意义和临床意义。
铁死亡的分子机制
铁死亡是一种由铁依赖性脂质过氧化引起的调节性细胞死亡。铁死亡的三个关键特征已被破解:膜脂过氧化、细胞内铁的可用性和抗氧化防御的丧失。
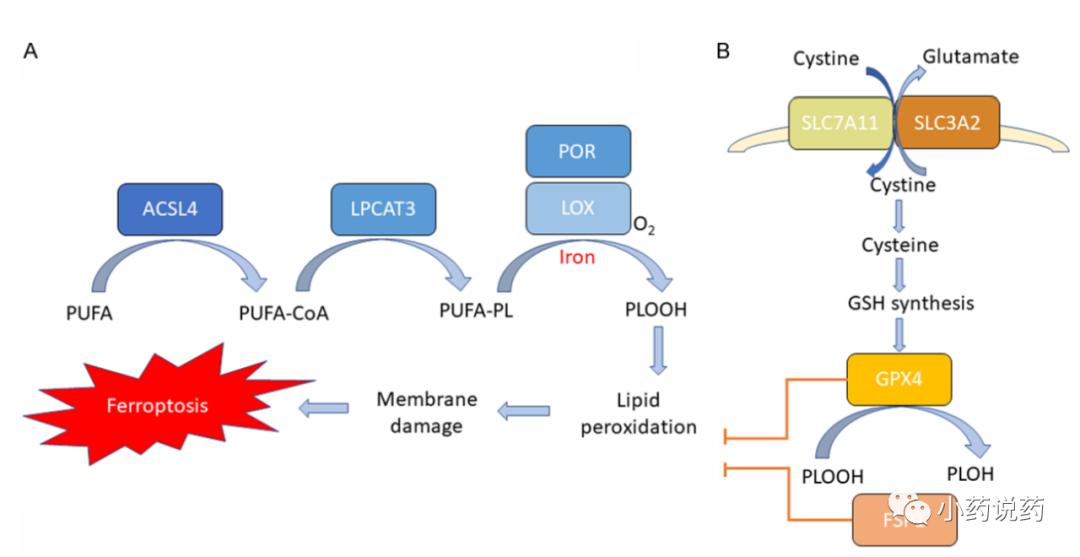
脂质过氧化
脂质过氧化导致脂质双层的破坏和膜的损伤,随后导致细胞死亡。细胞膜富含含有多不饱和脂肪酸(PUFA)的磷脂(PLs),极易受到ROS诱导的过氧化作用的影响。能够经受过氧化作用的膜PUFA的可用性对于铁死亡至关重要。
多不饱和脂肪酸需要合成、活化并整合到膜PLs中才能参与这一致死过程,这需要两种关键酶,酰基辅酶A合成酶长链家族成员4(ACSL4)和溶血磷脂酰胆碱酰基转移酶3(LPCAT3)。ACSL4能够催化长链多不饱和脂肪酸与辅酶A(CoA)的连接,LPCAT3促进这些产物的酯化和并入膜磷脂。
某些脂氧合酶(LOX)被认为是可以直接氧化膜双层中含有PUFA的脂质的主要酶。然而,LOX介导的铁死亡诱导机制仍有待进一步研究。另一种酶,细胞色素P450氧化还原酶(POR),最近被认为参与启动脂质过氧化。
铁积累
正如“铁死亡”这个名字所指,铁是执行细胞铁死亡所必需的。铁是芬顿反应不可或缺的元素,芬顿反应产生自由基并介导脂质过氧化。此外,铁是激活含铁酶LOX和POR所必需的,这两种酶负责氧化膜PUFA。此外,铁对于参与细胞活性氧产生的氧化还原代谢过程非常重要。
由于铁在铁死亡的发生中起着关键作用,细胞铁池通过调节细胞内铁储存、释放、输入和输出的相关基因而受到复杂的控制。细胞不稳定铁的变化影响细胞对铁死亡的敏感性。例如,据报道,铁输入转铁蛋白的增加或铁储存蛋白的降解可增加细胞铁的利用率并使细胞对铁死亡敏感。
抗氧化能力丧失
在正常情况下,铁介导的脂质氧化受到细胞抗氧化防御系统的严格控制。谷胱甘肽过氧化物酶4(GPX4)被认为是关键的抗氧化酶,直接作用于消除脂质双层中的氢过氧化物并防止致命脂质ROS的积累。
GPX4使用谷胱甘肽(GSH)作为底物,将膜磷脂氢过氧化物还原为无害的脂醇。GSH的合成是GPX4活性所必需的,需要三种氨基酸:半胱氨酸、甘氨酸和谷氨酸。半胱氨酸是谷胱甘肽合成的限速底物,是谷胱甘肽合成的重要组成部分。哺乳动物细胞内半胱氨酸的丰度主要受xc系统的两个亚单位SLC7A11和SLC3A2条调节。小分子抑制剂如erastin,可抑制SLC7A11介导的胱氨酸输入,可在多种癌症中诱发铁死亡。
最近发现了一种替代的GXP4非依赖性铁死亡抑制机制。铁死亡抑制蛋白1(FSP1)-CoQ系统能够保护细胞免受GPX4抑制诱导的铁死亡。FSP1可通过减少脂质自由基来防止脂质过氧化。因此,细胞利用两条途径,即cysteine-GSH-GPX4和FSP1 CoQ轴来抑制脂质过氧化和预防铁死亡。当这些抗氧化防御系统被铁依赖性脂质ROS积累所压倒时,就会发生铁死亡。
铁死亡与TNBC
不同类型的癌症对铁死亡的敏感性差异很大。最近的证据表明,TNBC中与铁死亡相关的代谢途径(如脂质、铁和氨基酸代谢)相关的基因表达发生了改变,使得这种难治性肿瘤本质上易受铁死亡的影响。TNBC对铁死亡的特殊敏感性突出了这种非凋亡死亡途径作为TNBC药物靶点的吸引力。
脂质代谢
脂质代谢失调可导致脂质过氧化和铁死亡,ACSL4是铁死亡执行的一个重要组成部分。有趣的是,研究发现,与其他类型的乳腺癌相比,ACSL4在TNBC中优先表达,其表达可预测其对铁死亡的敏感性。最近的一项研究还观察到ACSL4在TNBC肿瘤和细胞系中显著高表达。鉴于ACSL4使细胞膜富集长链PUFA,表明TNBC富含PUFA,因此对铁死亡特别敏感。
铁代谢
足够的细胞内铁是执行铁死亡的必要条件。与正常细胞相比,癌细胞表现出更高的对铁的依赖性以促进生长。最近的一项研究表明,与非TNBC肿瘤和细胞系相比,调节细胞内铁水平的基因在TNBC中明显高表达。特别是,在TNBC中观察到大量低水平的铁输出转运蛋白,伴随着铁输入转铁蛋白受体的高水平表达。这些参与铁代谢调节基因表达的改变可能有助于增加细胞不稳定铁库,促进铁依赖性脂质过氧化,使TNBC成为富含铁的肿瘤,易发生铁死亡。
氨基酸代谢
氨基酸代谢对于由SLC7A11介导的胱氨酸摄取、GSH生物合成和GPX4活性组成的抗氧化防御系统至关重要。癌细胞可能表现出对特定氨基酸代谢途径的依赖性改变,一项早期研究发现,与其他类型的乳腺癌相比,TNBC表现出明显依赖于补充SLC7A11所需的谷氨酰胺代谢,提示TNBC与铁死亡的潜在联系。
此外,与非TNBC肿瘤相比,TNBC肿瘤中GSH合成酶(GSS)的表达降低,GSH合成酶是GSH合成的关键酶之一。与其他类型的乳腺癌相比,TNBC中GPX4的表达也较低。低细胞内GSH和GPX4表达可能削弱抗氧化防御能力,增加脂质过氧化的可能性,使TNBC对促进铁死亡的药物特别敏感。
肿瘤免疫治疗中的铁死亡
最近发现,铁死亡有助于CD8+T细胞的抗肿瘤作用,并影响抗PD-1/PD-L1免疫治疗的效果。免疫治疗与促进铁死亡的方式相结合,如放射治疗和靶向治疗,可以通过铁死亡产生协同效应,以促进肿瘤控制。
免疫治疗与胱氨酸限制的联合应用
最近有报道称,抗PD-L1免疫疗法激活的CD8+T细胞通过PD-L1阻断后分泌IFN-γ促进肿瘤细胞铁死亡。分泌型IFN-γ显著下调肿瘤细胞中SLC3A2和SLC7A11的表达,导致胱氨酸摄取减少、脂质过氧化增强和随后的铁死亡。胱氨酸/半胱氨酸酶与抗PD-L1协同作用,通过诱导铁死亡可以产生有效的抗肿瘤免疫。
免疫治疗联合靶向治疗
最近的一项研究表明,抗PD-L1治疗的耐药性可通过与TYR03受体酪氨酸激酶(RTK)抑制剂的联合来克服,该抑制剂可促进铁死亡。在抗PD-1耐药的肿瘤中发现TYR03的表达增加。机制上,TYR03信号通路上调关键的铁死亡基因如SLC3A2的表达,从而抑制肿瘤性铁死亡。在TNBC同基因小鼠模型中,抑制TYR03可促进铁死亡并使肿瘤对抗PD-1疗法敏感。该研究揭示了通过使用TYR03抑制剂解除铁死亡是克服免疫治疗耐药性的有效策略。
免疫治疗联合放疗
最近的证据表明,放疗与免疫治疗的协同效应与对铁死亡的敏感性增加有关。辐射已被证明可诱发铁死亡,并且在经辐射处理的癌细胞中观察到铁死亡的遗传和生化特征。其机制涉及辐射诱导的ROS生成和ACSL4的上调,导致脂质合成增强、脂质过氧化增加和随后的膜损伤。因此,放疗的抗肿瘤作用不仅可归因于DNA损伤诱导的细胞死亡,还可归因于铁死亡的诱导。放疗与免疫疗法协同下调SLC7A11,由DNA损伤激活激酶ATM和IFN-γ介导,导致胱氨酸摄取减少、铁死亡增加和肿瘤控制增强。这些研究揭示了铁死亡是免疫治疗和放疗协同作用的一种新机制。
免疫治疗与T细胞铁死亡抑制剂的联合应用
除了诱发肿瘤性铁死亡外,T细胞本身也可能发生铁死亡,这可能会减弱其免疫反应。缺乏GPX4的T细胞迅速积累膜脂质过氧化物,同时发生铁死亡。与癌细胞类似,ACSL4对CD8+T细胞的铁死亡及其免疫功能也是必不可少的。
最近,两项研究表明,CD8+肿瘤浸润淋巴细胞中CD36的表达增加。T细胞固有的CD36促进氧化脂质的摄取并诱导脂质过氧化,从而导致CD8+T细胞功能障碍。这些发现揭示了CD8+T细胞铁死亡是肿瘤免疫抑制的一种新模式,并强调了阻断CD36以增强抗肿瘤免疫的治疗潜力。值得注意的是,该研究还表明GPX4在调节CD8+TIL的抗肿瘤功能中发挥作用。因此,通过GPX4抑制剂在癌细胞中治疗性诱导铁死亡可能会对T细胞产生不必要的靶向效应,并产生不良毒性。
小结
铁死亡是由含有PUFA的脂质的氧化、细胞内铁的积累和抗氧化防御的丧失所驱动的。铁死亡的调节在包括TNBC在内的多种癌症类型中都有作用。特别是,TNBC表现出铁死亡相关基因的独特表达模式,使其特别容易受到铁死亡诱导物的影响。因此,针对这种难治性肿瘤,靶向铁死亡可能是一种有希望的治疗策略。
此外,铁死亡在T细胞介导的抗肿瘤免疫中起重要作用,影响免疫治疗的效果。通过直接或间接诱导铁死亡,如放射治疗和靶向治疗,成为改善抗PD-1/PD-L1免疫治疗的有希望的组合方式。因此,有必要进一步探索结合免疫治疗的铁死亡调节方式。这些发现将拓宽和加深我们对这种新的细胞死亡形式的理解,并为未来的研究方向提供新的机会。
参考文献:
1.Ferroptosis: a promising target for cancer immunotherapy. Am J Cancer Res. 2021; 11(12): 5856–5863.
原文标题 : 靶向铁死亡的肿瘤免疫治疗

图片新闻
技术文库
最新活动更多
-
4月23日立即报名>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
4月25日立即报名>> 【线下论坛】新唐科技2025新品发布会
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论