当网售处方药合法、“假”药不假、GMP/GSP消失后,《药品管理法》带来的5大变化和14大要点
药品上市许可持有人制度,打破“研产销”一体化格局
上市许可持有人制度,就是拥有药品技术的药品研发机构和生产企业,通过提出药品上市许可的申请,获得药品注册证书,以他自己的名义将产品投向市场,对药品全生命周期承担责任的一项制度。
2015年11月,我国开始开展药品上市许可持有人制度试点,正式文件于2016年5月下发,并在随后的三年中取得了积极的成效。根据规定,上市许可持有人要建立质量保证体系,对药品的非临床研究、临床试验、生产经营、上市后研究、不良反应监测、报告及处理等全过程、各环节都要负责。要求上市许可持有人不仅要具备质量管理、风险防控能力,还要具备赔偿能力。这种责任到人的管理模式将为医药企业带来更大的压力,促进行业的规范化发展。
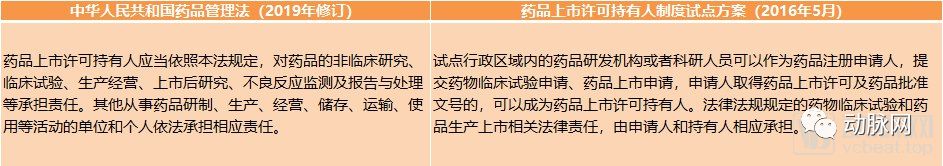
关于药品上市许可持有人的政策变化(动脉网整理)
除了责任到人,药品上市许可持有人制度的另一个关键作用就是从制度设计上鼓励创新。在本次法规中明确表明了药品上市许可持有人可以“委托药品生产企业生产”,也可以“委托药品经营企业经营”。上市许可持有人只需要在药品的生产流通过程中进行监督,并保证药品的可追溯就可以了。
对于创新药企业而言,新法规打破了“研产销”一体化的格局,让各个环节上的企业可以进行自由组合,各尽其职,提升药物创新效率。
苏桥生物CEO王永忠博士表示:“‘研产销’流程被打散是对CMO行业的重大利好,但我们还希望看到国家能进一步放宽政策。希望看到生产环节中的原液和制剂生产也可以被分离。这将会是对创新药,尤其是生物药行业更大的利好。”
“药品全周期管理对于CRO来说是个关键性的利好消息。” 一位CRO行业的资深从业者这样告诉动脉网,“药品在上市后其实还有很多相关的临床内容要做,比如安全性跟踪、Ⅳ期临床试验、安全警戒等。过去这些内容大家都不够重视,行业中做的量也很小。现在正式的法规提出来了,肯定会有更多的药企在这方面进行投入。”
临床试验、创新药审批加速,全面助力药物创新
国家近年来的政策走向持续向创新药敞开,用实际行动助力国产创新药发展。
本次《药品管理法》中为鼓励研究和创制新药专门增加了药品研制和注册的章节,正式将鼓励药物创新写进了国家法律法规当中。
在全国人大常委会办公厅新闻发布会上对政策的解读中,需关注6个要点:
1、明确了鼓励方向,重点支持以临床价值为导向,对人体疾病具有明确疗效的药物创新;
2、创新审评机制,强化审评机构能力建立,完善与注册申请人的沟通交流机制,建立专家咨询制度,优化审评流程,提高审评效率,为药物创新提供了组织保障;
3、优化了临床试验管理,提高临床试验的审批效率;
4、建立关联审评审批,在审评审批药品的时候,将相关的其他用品调整为与制剂一并审评审批;
5、实行了优先审评审批,对临床急需的短缺药、防治重大传染病和罕见病等疾病的新药、儿童用药开设绿色通道;
6、建立了附条件审批的制度,缩短了临床试验的研制时间,使那些急需治疗的患者能第一时间用上新药。
创新药审评在近两年持续提速。根据CDE公布的《2018年度药品审评报告》,2018年药申中心受理1类创新药的新药上市申请(NDA)25个品种,较2017年增长了150%。其中,受理1类化药创新药NDA 16个品种,较2017年增长了100%;受理1类生物制品NDA 9个品种,较2017年增长了4.5倍。
2018年底排队审评的注册申请已由2015年9月高峰时的近22000件降至3440件。

临床试验默示许可政策变化(动脉网整理)
在新修订的法规中,很多近年来推行的药审新政都被正式纳入了《药品管理法》当中。临床试验申请60天默示许可、药物临床试验伦理审查、急需药附条件批准等都有相应的条款规定。而其他一些方面,儿童用药和罕见病新药的优先审评、临床试验机构注册制改为备案制等条例,都能明显表现出国内政策向国际化靠拢的态势。
“儿童用药和罕见病新药的特殊批准条例对于我们来说也意味着新的机会。过去因为儿童用药和罕见病新药的临床实验困难,所以很多药企都不愿意在这个方向上投入。现在新的政策在推动这些行业的发展。有药企愿意在这些行业中投入,我们就会获得相应的机会。”CRO资深从业者说。
另外,针对社会各界高度关注的常用药、急用药短缺的问题,新修订的药品管理法也专章规定了药品储备和供应,提出了标本兼治、多部门协同的要求。
GMP、GSP被删除,归入药品生产许可和经营许可一并检查
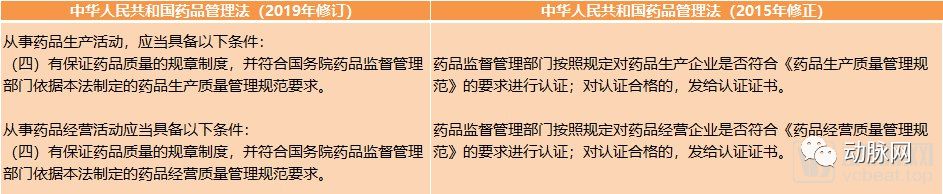
关于GMP、GSP监管的政策变化(动脉网整理)
在新法规的药品生产章节中,将“符合国务院药品监督管理部门依据本法制定的药品生产质量管理规范要求”列入了开办药品生产企业的必备条件中。原法规中有关《药品生产质量管理规范》认证的部分被删除。同样的情况也发生在有关《药品经营质量管理规范》的内容中。
取消认证并不是取消了GMP、GSP标准,而是将GMP、GSP标准的硬指标附加到了药品生产许可和经营许可的检查过程中。这也就意味着一旦GMP、GSP不达标,企业会因此直接失去药品生产许可或经营许可,其实是变相的提高了对于药企的要求。
另外,本次法规修订也对建立专业化、职业化药品检察员队伍进行了规定。而且根据相关数据统计,国家药监局近两年的药品飞检频率持续提高。飞检频率的提升加上检查队伍素质的提高,将会进一步约束药企的不合规行为,起到强化药品安全监督检查的作用。
取消GMP、GSP认证其实和临床机构备案制是同样的思路,就是希望减少认证,更多的依靠后期监管来对行业进行监督。“国家在监管环节上主要的难点在于药物安全警戒体系的构建,尤其是在落地进程上,如何把监管控制在合适的尺度范围内将会是最值得讨论的话题。”苏桥生物CEO王永忠说。
对于《药物管理法》最终落地对行业的影响,王永忠认为药物研发和生产领域不太可能会发生太大的变化:“在近几年药事法规的变革过程中,中国的整个医药行业已经做好了充分的预判和迎接变化的准备。这次的《药品管理法》修订更多的是为行业的发展提供了法律法规上的支持,并不太可能会引起行业内部的大地震。”

文 | 郝翰 张晓旭
网站、公众号等转载请联系授权

图片新闻
最新活动更多
-
4日10日立即报名>> OFweek 2025(第十四届)中国机器人产业大会
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> 【上海线下】设计,易如反掌—Creo 11发布巡展
-
精彩回顾立即查看>> 【线下论坛】华邦电子与莱迪思联合技术论坛
-
精彩回顾立即查看>> 【线下论坛】华邦电子与恩智浦联合技术论坛
-
精彩回顾立即查看>> 2024(第五届)全球数字经济产业大会暨展览会







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论