迈向未来: 肿瘤的精准治疗时代
基因组和蛋白组学的技术突破不断驱动肿瘤生物学向前发展,癌症的前瞻性分子特征使医生能够实时确定每个患者肿瘤的基因组变化,并能够根据这些详细的数据选择个性化的治疗方案。虽然目前只有少数患者受益于精准靶向治疗,但随着该领域的进展,这一群体将继续增长。
精准肿瘤学的范围正在迅速扩大,以解决以前无法克服的靶标和罕见的基因组驱动因素,同时,以前未被认识到的生物和治疗的复杂性也正在出现。如何进一步扩大基因组驱动肿瘤学的益处,包括提出改进药物设计的策略,更细致的患者选择,以及设计下一代基因组驱动的临床试验,将有助于加速我们对肿瘤生物学的理解,并持续改善患者预后。
优化药物开发
目前,基于精准肿瘤学的新一代疗法有助于阐明最佳分子靶向药物的许多关键特性。其中最重要的因素包括治疗指数、靶向选择性和耐药性。
治疗指数
一个良好的治疗窗口以允许最佳剂量,是治疗成功的关键。治疗指数是药物选择性、靶点特征和脱靶毒性综合考量的结果。
例如,EGFR抑制剂的治疗窗口因靶向激活突变与野生型EGFR的选择性不同而有所不同。许多对一代和第二代EGFR抑制剂(如erlotinib、gefitinib和afatinib)反应良好的患者,都有L858R突变和外显子19缺失,这些缺失增加了受体二聚并降低ATP结合,与野生型EGFR相比,抑制剂的亲和力增强。
相比之下,这些药物在EGFR外显子20插入中具有较差的治疗指数,因为对外显子20突变体的抑制作用不如对野生型EGFR的抑制,限制了这类药物的耐受性。
靶标选择性
针对靶标的选择性可以降低脱靶毒性,并允许更有效的药物活性,从而提高疗效。

例如,在约2%的肺腺癌和高达20%的甲状腺乳头状癌中发现活化RET改变,而多重激酶抑制剂(MKI)会有一定程度的RET抑制,如lenvatinib、vandetanib、cabozatinib和ponatinib,在RET突变的肿瘤中表现出有限的临床活性。然而,所有这些药物都表现出更强的非靶向抑制作用,典型的是VEGFR(KDR),这决定了它们的剂量限制毒性,从而无法达到最大的RET阻断。
相反,选择性RET抑制剂,包括selpercatinib(LOXO-292)和pralsetinib(BLU-667),已经被开发出来,允许有效和持续的靶向抑制,与MKIs相比,已证明具有显著的疗效和良好的安全性。
所以,对单个癌症的基因组驱动因素的进一步了解,加上结构生物学的进展,使得能够开发出合理的、适合于特定目的的药物,这种选择性抑制剂的产生对于优化耐受性和最大化治疗效果至关重要。
耐药性
在设计药物时,应考虑原发性和获得性耐药的潜在机制。考虑因素包括由药物渗透性引起的耐药性以及继发于分子改变的耐药性。
对于脑转移常见的癌症,包括NSCLC、乳腺癌和黑色素瘤,确保针对这些癌症关键基因组改变的药物具有足够的中枢神经系统(CNS)渗透性已成为一个关键设计参数。虽然第一代ALK抑制剂crizotinib可实现高初始全身疾病控制率,但脑部渗透性差导致多达60%的患者在接受治疗时出现CNS进展。对新一代ALK抑制剂的前瞻性评估表明,大脑内的疾病控制显著改善,最终有助于提高无进展生存率和总生存率。

除了由药物渗透性决定的耐药性外,药物开发越来越多地考虑到靶向获得性耐药性的预测机制。例如,连续几代的ALK抑制剂被专门设计针对突变来维持结合效力。
药物开发的新领域
异构体和突变选择性抑制剂
认识到更多的选择性治疗往往具有更好的疗效和耐受性,一些策略被用来更具体和直接地抑制致癌驱动因素,包括开发异构体和突变选择性抑制剂。
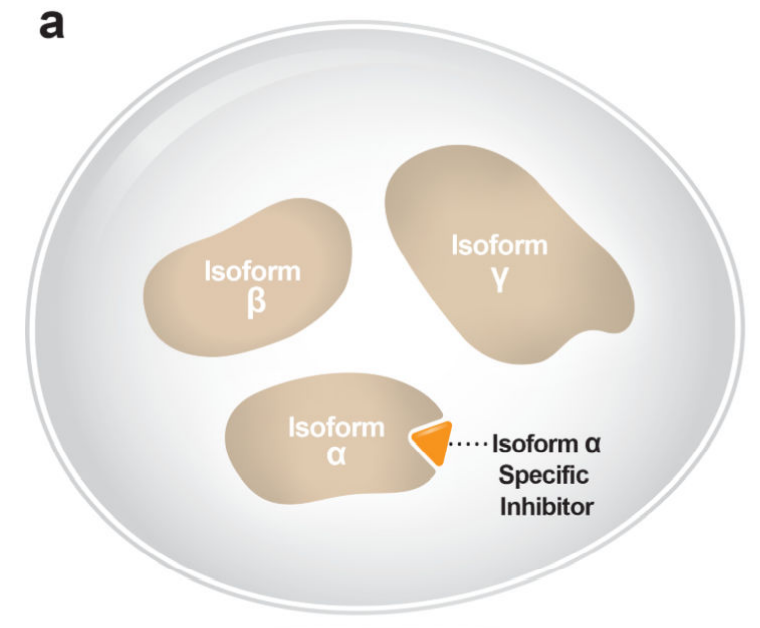
例如,PI3K途径是癌症中最常见的突变途径之一,但早期用pan-PI3K抑制剂仅显示出有限的疗效。相比之下,亚型选择性PI3K抑制剂相对于pan-PI3K和双PI3K/mTOR抑制剂显示出更好的疗效。此外,异构体特异性抑制剂可将归因于“脱靶”异构体的毒性降至最低。

图片新闻
技术文库
最新活动更多
-
4月23日立即报名>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
4月25日立即报名>> 【线下论坛】新唐科技2025新品发布会
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论