突破药研壁垒:病毒、脂质体、外囊泡、ADC
根据细胞外囊泡(EVs)的生物合成或释放途径,可以对囊泡进行分类:外泌体(exosomes)、微粒/微囊泡(microparticles/microvesicles)、凋亡小体(apoptotic body/bleb)、肿瘤小泡(large oncosomes),以及其他各种EV亚群。外囊泡膜可抵抗胞外环境核酸酶的降解作用,因此可作为小分子核酸药物载体,这方面的应用已有大量文献报道。
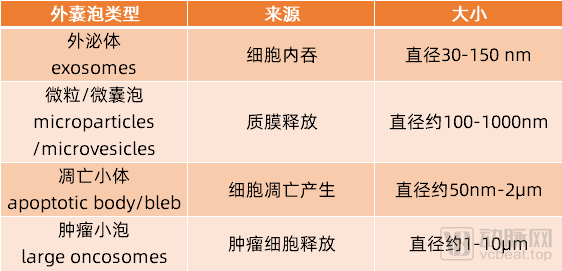
几种外囊泡对比
目前,产业界用以载体开发的外囊泡(EVs)主要有三种:人源工程化外泌体、人类间充质干细胞(MSCs)来源的外泌体和红细胞/血小板等无核细胞来源的外泌体。工程化外泌体因为可以修饰其靶向并且提升药物装载效率,目前是产业界的主流。MSCs来源的外泌体大约40-80nm大小,可以递送20-30 bp微小RNA,红细胞来源的外泌体由于受到红细胞本身特质的影响最长可以携带30 kb的DNA。
2偶联靶向递送:自由搭配靶头,高壁垒“生物导弹”
与载体递送方式不同的是,偶联靶向技术是用一个Linker(连接子)将药物和具备靶向递送功能的分子相连接,形成的具有靶向递送功能的偶联药物。最常见的如有ADC药物,最早被开发应用为“生物导弹”,利用生物大分子(抗体)的特异性,定向把小分子毒素(非特异性)送到病灶(如癌细胞),实现特异性杀灭癌细胞,而不影响正常细胞。
ADC药物的起源可以追溯到1980年,最初的设想是将单克隆抗体靶向治疗与传统化疗相结合,使其在抗癌方面既具有靶向的高度选择性,又具有化疗的强大杀伤力。
目前,ADC药物主要由抗体-Linker(连接子)-药物三部分构成。其中,Linker连接的药物多为细胞毒素,毒素相当于弹头,用于杀伤肿瘤细胞;抗体相当于制导装置,将毒素精确导航到靶点;连接子将抗体与毒素相连接,在细胞内释放毒素。
根据Nature预测,2020年以前上市的10款ADC产品到2026年销售总额将超过164亿美元。国内ADC市场在2020年启动,预计2024年及2030年分别达到74亿及292亿人民币的规模,2024年至2030年复合年增长率为25.8%。
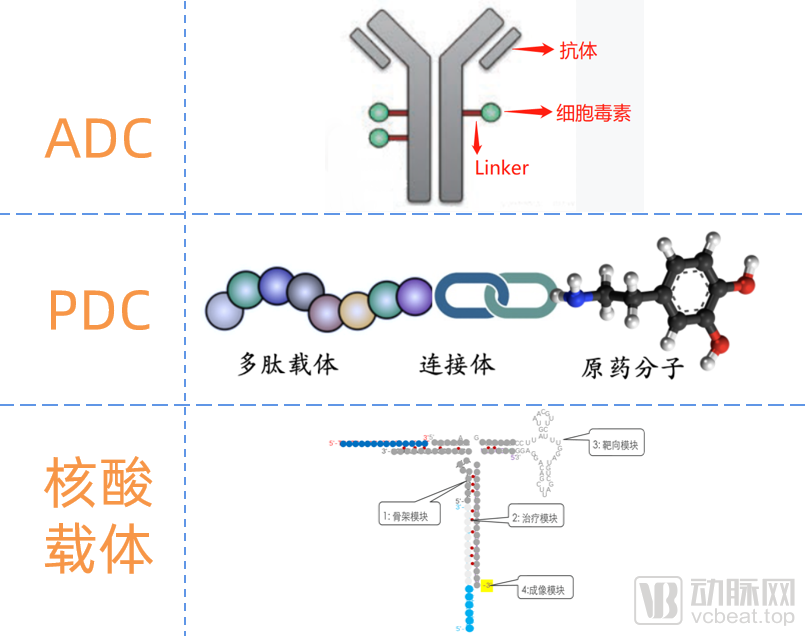
偶联靶向递送的几种药物形态
除了ADC,近年来还出现了多肽偶联药物(PDC),它和抗体偶联药物(ADC)类似,将其抗体-Linker(连接子)-药物三部分中的“抗体”替换成了“多肽”,同样可以具备靶向递送功能。
PDC通过一个可分解的Linker将特定的多肽序列与细胞毒素共价结合,以提高局部细胞毒素浓度的形式靶向患病组织,减轻非疾病组织中的毒性效应,减轻不良反应,达到增效减毒的目的。
PDC整合了多肽的优势,具有较小的分子量,可生物降解的同时不会引起免疫原性反应。通过修饰肽链的氨基酸序列,可改变PDC共轭疏水性和电离性质,解决水溶性差、代谢不及时等问题,同时促进细胞和组织通透性,攻克了小分子药物由于理化性质欠佳在临床开发中磨损率高的难题。一些特定的多肽载体还能克服肿瘤耐药性,以及实现跨血脑屏障的药物递送。此外,相比于ADC技术,多肽偶练药物PDC具有多种产业性优势,例如更好的均一性,更低的生产成本和周期等。
不止ADC、PDC药物可以作为“生物导弹”,临床上还有抗体细胞偶联药物(ACC)、病毒样药物偶联物(VDC)、抗体片段偶联药物(FDC)、抗体寡核苷酸偶联物(AOC)、抗体免疫刺激偶联物(ISAC)、抗体生物聚合物偶联物(ABC)等偶联药物都可以实现递送功能,但在这些领域产业研究比较少,所以本文不做过多解读。
除了偶联药物,还有一些直接提供“连接体(Linker)”的递送技术。例如通过设计组装核苷酸形成特定药物载体,使其与目标分子(包括具有靶向功能的大分子)的底层核酸序列偶联,成为具备特定靶向递送功能的核酸药物。
相较于ADC、PDC药物,纳米核酸载体能够实现多靶向适配体挂载,提升适配体介导药物与靶细胞特异性结合;通过接头设计确保靶向适配体不折叠,立体构象完整,保证了适配体介导的特异性和亲和力;且靶向适配体和药物整体分子量比值合理,提高了适配体介导药物与靶细胞特异性结合几率。纳米核酸载体可以以序列延展方式挂载核苷酸片段和大部分N环类化药等。
国内药物递送先行者:药企们都使用哪些递送技术?
了解了递送技术的多种多样,那么国内有哪些企业正在这个赛道发力呢?
首先,从病毒载体方面来看,基本上国内从事基因治疗的药企普遍采用都是病毒载体,包括有奥源和力、至善唯新、辉大基因、信念医药、安龙生物等近20家国内药企正在使用病毒载体进行基因疗法开发。
另一方面,国内也有不少提供专业病毒包装技术服务的CRO/CDMO,例如有源兴基因、吉凯基因、和元基因、白泽生物、汉恒生物、赛业生物等10余家企业,都能输出品类多样的临床用病毒载体。

值得介绍的是,本导基因自主研发的一种类病毒(VLP)递送技术,递送载体是一种介于病毒载体与非病毒载体之间的类病毒体,利用mRNA茎环结构与噬菌体衣壳蛋白特异识别的原理,通过病毒工程技术,将病毒和mRNA两者的优点完美地结合起来,创造了新型递送技术VLP-mRNA。类病毒载体一方面借助了病毒的外壳,使得其感染细胞的效率特别高,另一方面,则基于mRNA的自身瞬时性的特点,能让基因编辑治疗更加安全可控,降低脱靶效应。据悉,本导基因的VLP已经进入了临床IIT阶段。
与病毒载体和基因治疗的强关联不同,脂质体(LNP)作为递送载体,与之关联的不仅有前沿的mRNA疫苗,还有各类抗癌化疗药物,以及对药物缓释、药物吸收有需求的临床药物都可以采用脂质体(LNP)作为递送载体。
例如,竞诺择生物在基础的脂质体(LNP)技术之上,创新研发了一种“多药脂质体技术”,通过控制脂质体的载药量和释放速度,在保证疗效的前提下降低药物副作用;再通过修饰脂质体的表面,提高脂质体的靶向性,控制药物在体内的分布和作用时间。该技术能够让联合使用的药物在体内的分布和半衰期发生变化,药物在体内分布将趋向一致,以此改善药物的代谢行为,增强联合化疗的协同作用,弥补现有方法的不足,提高治疗效果。
不过围绕脂质体(LNP)最前沿的研究还是建立在核酸疫苗之上,因为疫苗注射本身对其靶向性要求不高,所以成为核酸疫苗注射首选的药物载体。在国内,深信生物、传信生物围绕RNA药物(多为疫苗)展开的研究都是借助了脂质体(LNP)作为递送载体,脂质体(LNP)成为传染疾病mRNA疫苗最具潜力的递送技术。
其中,深信生物采用的脂质体(LNP)是一种可离子化阳离子的脂质纳米粒,内部可以很好负载核酸药物,相对于AAV病毒载体,这种载体具备更大的递送空间和更好的重复递送性。
另外,值得一提的还有渤因生物,该公司围绕核酸(DNA)药物/基因治疗展开创新药研发,采用的却不是病毒载体,而是一种非病毒可重复递送的药物载体。据了解,该非病毒载体正是基于脂质体(LNP)基础之上研发而来针对DNA递送特异优化的创新载体。
其次在外囊泡载体方面,目前国内主要有恩泽康泰、博泌生物、宇玫博生物等企业正在做相关研究。其中,恩泽康泰主要是基于外囊泡中外泌体一类型作为大分子递送载体,通过工程化改造的方式对外泌体进行改性,大幅提高了外泌体携带特定有效成分,包括多肽、蛋白质、核酸药物的载量,并实现特定器官的选择性递送。
而博泌生物采用的是红细胞外囊泡(RBCEV)载体递送,公司先从O型血捐献者的血液中分离红细胞,在体外诱导使其分泌RBCEVs,然后经过纯化得到高纯度的RBCEVs。RBCEV可以装载多达30kb的DNA片段,以及mRNA、反义寡核苷酸、siRNA等其他核酸药物。由于红细胞自身没有细胞核和线粒体,也保证了分泌后的RBCEVs中核酸量含量极少,形成天然的空白核酸运载载体。
除了前文提及的载体制剂递送,中国从事ADC药物研发的企业超过20家,包括有荣昌生物、乐普生物、康诺亚、嘉和生物等;从事PDC药物研发的另有安医生命科技(N1 Life)、泰尔康医药、主流生物、同宜医药、盛诺基医药等不到10家,该领域在国内还处于开发的洼地,研究公司并不多见。
例如,安医所使用的Linker连接的多肽不仅能够靶向肿瘤微环境,使药物肿瘤形成富集,让肿瘤组织内部药物富集,从而提高药效浓度、药物吸收效率,降低药物毒副作用,同时还利用多肽载体克服肿瘤的多重耐药性,甚至扩大原始药物的适应症;康源久远用linker链接PEG化的毒素,克服了传统ADC耦联技术的随机性缺陷。
百药智达的纳米核酸药物合成工艺
最后,值得介绍的还有一家专门从事递送技术服务的药企——百药智达,该公司以核苷酸和修饰物为材料,仿生tRNA人工合成多条寡核苷酸RNA或DNA链,遵循碱基配对原理自主装配成T型药物载体系列;该载体动态粒径约10nm(挂载药物和靶向后约15nm),呈稳定超螺旋结构立体构象,具有优良热力学、酸碱、血液生理、酶学稳定性;同时,百药智达开发出系列序列延展、缀合、偶合方法,可以高效挂载各类靶头及药物效应分子,灵活成药。
后记:没有最好的载体,只有最适合的递送技术
递送技术在医疗产业中是一个非常大的盘子,从我们前文的研究可以看到,每一种递送技术几乎都有与之对应的契合的研发药物。例如,核酸药物最常见的是采用病毒载体,究其缘由是病毒载体的感染能力高、宿主范围广、同时表达多个基因等优势都很适用于核酸药物的运载。
当然,围绕病毒载体本身的短板,也成为前沿科学家们致力于克服的地方,病毒的不可重复递送性、随机整合风险等,也就诞生出了诸如类病毒(VLP)载体类型,以及像渤因生物一样尝试用非病毒载体克服AAV病毒短板进行基因治疗的企业。
提到非病毒载体,脂质体(LNP)则成为产业的宠儿,基于被递送药物的属性差异,药企开始围绕脂质体进行的各类升级,以高效适应递送目标药物,纳米脂质体、阳离子纳米乳、多药脂质体等,成为产业发展的一大方向。由于脂质体(LNP)的非主动靶向性,目前成为核酸疫苗的首选递送技术,强大的可离子化磷脂化学结构改造优化能力,以及解速度快,产量高等优势,未来的应用前景巨大。
相较病毒和脂质体(LNP)而言,天然的外囊泡则可以被认为最前沿的第三代递送技术。不仅易于设计靶向性,还能天然运载大分子,且低免疫原性,有望弥补现有递送技术的不足,成为独具优势的给药系统。然而,目前国内从事该领域的企业并不多,技术工艺也需要进一步完善。不过据业内人士透露,目前国内诸多药企已经开始尝试使用外囊泡递送技术替代原有递送方式,以提高药物递送效率等相关属性。
最后是我们提及小分子药物,可以偶联单抗、多肽等形成靶向药物,定向导航到病变(多为肿瘤)部位。与此同时,连接小分子药物和大分子单抗/多肽的linker也可以成为科学家们优化的对象,以及如何提高这些偶联药物的均一性,也是前沿药企需要解决的问题。所以,也有药企尝试直接构建核酸载体,将需要运载的药物直接“回归”到核苷酸序列本身,与纳米核酸载体相连形成稳定的核酸复合物,解决药物递送均一性问题。
综上所述,医药界对递送技术的探索是永无止境的,永远在研究更为高效、完美的递送系统。递送系统与医药是协同发展,递送在医药领域无处不在,也将是医药产业发展中一个永恒的话题。
特别鸣谢:
百药智达合伙人 魏鸿
竞诺择生物创始人 冯皓
恩泽康泰CEO 孔关义
深信生物创始人 李林鲜
渤因生物创始人 潘雨堃
Carmine Therapeutic联合创始人 史家海
科凝生物创始人 余渝
本导基因创始人 蔡宇伽
安医生命科技(N1 Life)创始人 臧晓羽
康源久远CEO 刘树民
和度生物......
作者:王婵

图片新闻
技术文库
最新活动更多
-
4月23日立即报名>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
4月25日立即报名>> 【线下论坛】新唐科技2025新品发布会
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论