2022年创新药行业研究报告
第一章 行业概况
创新药,也称为原研药,是一个相对于仿制药的概念,指的是从机理开始源头研发,具有自主知识产权,具备完整充分的安全性有效性数据作为上市依据,首次获准上市的药物。新药上市要经历化合物的发现和研究、临床前研究、临床研究和上市后研究几个研究阶段,其中关键的审核流程包括临床研究申请和审核、新药注册申请和审核。
图:国内创新药上市流程
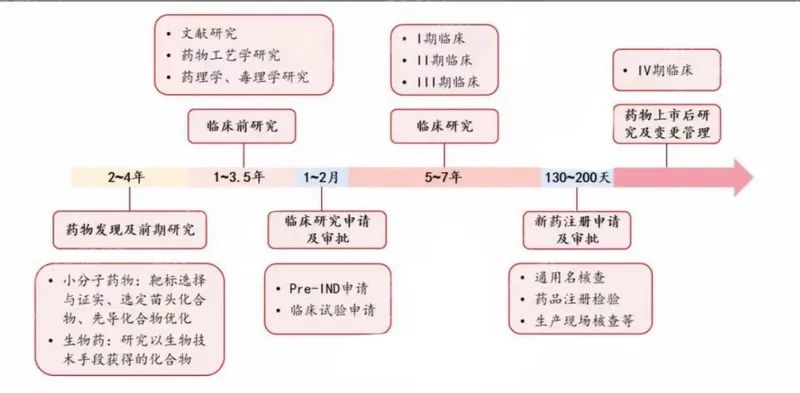
资料来源:资产信息网 千际投行
1.1 全球创新药行业发展现状
全球创新药市场规模从2014年的7384亿美元增长到2018年的8487亿美元,CAGR为3.5%,预计2023年市场规模将达到10345亿美元。
图:全球创新药市场规模

资料来源:资产信息网 千际投行
2021年,美国在全球创新药销售额的占比超过一半,而其他发达国家中,欧洲五国占比达到16%,日本韩国占比达到8%,中国仅3%,远低于发达国家水平。

资料来源:资产信息网 千际投行
创新药的研发具有高风险高投入的特性,从I期临床到获得FDA批准上市的成功率平均仅为7.9%,意味着药企需要至少布局12款药物中才有1款可能成功,因此研发投入较大。据统计,2021年全球创新药的研发平均成本为20.06亿美元,平均研发的时间周期为6.9年。

资料来源:资产信息网 千际投行
医改启动后,一级市场一度掀起创新药投资热潮,投资金额和数量快速增加。然而,随着近期创新药企业近年上市破发情况屡见不鲜,一二级市场严重倒挂,投资回报率大幅下降,一级市场对这一板块的热情降温,叠加宏观经济影响,2022年Q1的创新药投融资创下近年新低,同比下滑幅度较大。

资料来源:资产信息网 千际投行
1.2 国内创新药行业发展现状
我国获批的创新药数量近年来整体呈增长态势,2021年国内共有89款创新药获批,其中生物创新药31款,化药创新药46款,中药创新药12款。

资料来源:资产信息网 千际投行
从获批创新药的治疗领域来看,2021年,我国获批的创新药主要集中在肿瘤、抗感染及心脑血管和代谢领域,分别占比27%、14%和12%。并且由于我国创新药研发起步较晚,目前国内药物销售市场主要以仿制等其他药物为主。2021年,我国创新药销售额占比仅18%,其他药物占比82%。
但是我国创新药逐步获得国际认可。近年我国创新药企业在license-out方面有较多成果,License-out项目数量快速提升,代表着部分产品和企业正在迈出国门,走向全球市场。
图:国内已申报的创新药分类

资料来源:资产信息网 千际投行
第二章 商业模式和技术发展
2.1 产业链
图:创新药产业链

资料来源:资产信息网 千际投行

资料来源:资产信息网 千际投行
创新药行业产业链主要分为三个环节。产业链上游参与主体为原材料供应商,主要包括相关专利提供商、制药装备提供商、医学设备和器械提供商、实验耗材提供商等。产业链中游参与主体是相关药物生产商,包括大型跨国制药企业、本土大型药企和初创企业;下游主要集中在全国各级医疗机构和院内DTP药房。中上游企业具有强烈的创新需求和驱动力,成为整个产业价值创造的核心引擎。
上游
1、医药中间体
医药中间体是医药化工原料至原料药或药品这一生产过程中的一种精细化工产品,化学药物的合成依赖于高质量的医药中间体。根据数据显示,2019年我国医药中间体市场规模达1996亿元,2020年我国医药中间体市场规模达2090亿元,同比增长4.71%;预计2021年我国医药中间体市场规模可达2208亿元。
重点企业有常州制药厂有限公司、南通宏慈药业有限公司、浙江美诺华药物化学有限公司等。

资料来源:资产信息网 千际投行
2、中药种植
中药材指在汉族传统医术指导下应用的原生药材,用于治疗疾病。一般传统中药材讲究地道药材,是指在一特定自然条件、生态环境的地域内所产的药材,因生产较为集中,栽培技术、采收加工也都有一定的讲究,以致较同种药材在其他地区所产者品质佳、疗效好。根据数据显示,2020年我国中药材市场规模为1919亿元,较2019年同比增长16.09%。
重点企业有白云山、康美药业、昆明制药等。

资料来源:资产信息网 千际投行
中游
1、市场规模
自2015年以来,创新药物的政策环境不断优化,创新活动不断释放,逐步打破了国内创新药研发的坚冰局势,加快了行业发展速度。根据数据显示,2019年我国创新药市场规模达1325亿美元,2020年我国创新药市场规模达1400亿美元,同比增长5.66%;预计2021年我国创新药市场规模可达1467亿美元。
重点企业有景峰医药、哈三联、海翔药业、华东医药等。

资料来源:资产信息网 千际投行
2、临床试验项目数量
我国对创新药物的重视程度逐步提升,企业的研发投入逐渐加大,助力了我国创新药市场的蓬勃发展。根据数据显示,2019年我国创新药临床试验项目数量为10516个,2020年临床试验项目数量为13862个,同比增长31.81%。

资料来源:资产信息网 千际投行
下游
1、应用领域使用情况
从近5年引进的创新药项目所处阶段来看,在疾病领域肿瘤占比较大,占比达40.6%,其次是血液领域,占比达12.7%。
图:2021国内获批创新药分布(按疾病领域分类)

资料来源:资产信息网 千际投行
2、医药零售
(1)市场规模
医药零售是指直接将药品或服务销售给个人消费者或最终消费者的商业活动,是药品或服务从流通领域进入消费领域的最后环节。根据数据显示,2011-2020年零售药店的药品销售持续增长,医药分开大势所趋,院外药品零售市场规模持续扩增。

资料来源:资产信息网 千际投行
(2)医疗机构
创新药最大的应用领域是医疗行业。根据数据显示,2020年我国卫生机构数量为102.3万个,2021年1-3月我国卫生机构数量为102.6万个,同比增长1.72%。
图:中国医院和医疗机构数量

资料来源:资产信息网 千际投行
2.2 商业模式
药企本质的商业模式,是要实现“制药价值循环”,即包括药物发现、临床开发、生产、销售四个步骤:
药物发现:药物分子本身的靶点选择、结构设计、剂型等因素是药物临床价值的起点;从靶点或者药物分子设计优化开始,到成药上市往往需要十年以上的时间,短期内无法变现,但对企业的远期潜力影响深远;
临床开发:通过临床试验对分子的临床价值进行验证,临床价值是实现商业价值的前提;进入临床开发阶段之后,药物分子距离获批上市又进一步,决定了企业的中期发展后劲强弱;
生产:更大的生产规模意味着能够覆盖更多的患者,是商业推广的坚实后盾;更低的生产成本则可以帮助企业实现更高的利润率和现金流,并且可以在未来可能的价格战中占据优势;
销售:企业的学术推广是将药物分子的临床价值变现的关键能力;销售收入是决定企业短期业绩增长的核心,也是产生现金流支持下一轮 药物发现、临床开发的驱动力。
当药企的四个经营环节能够完善运行,产生正向的制药价值循环,才是一个完善的创新药企业商业模式。
图:制药价值循环

资料来源:资产信息网 千际投行 光大证券
图:海外创新药商业模式

图:国内创新药商业模式

资料来源:资产信息网 千际投行
创新药商业模式为销售高毛利药物,在海外能达到90%以上,国内目前则大致为80%。这些利润投入研发,并且配合并购和引进项目。研发出的药物上市享有专利保护,进行销售进入循环。专利到期的药物退出这个循环,在海外是专利悬崖,价格暴跌剩下一个残值。国内则是仿制药集采。这个商业模式中国和海外最大的差异是新药上市以后海外在专利保护期无需降价而国内想进入医保需要进入医保谈判,这时候必须大幅度降价才有机会进医保。
2.3 技术发展
对国内创新药行业的各个专利申请人的专利数量进行统计,排名前列的公司依次为:科伦药业、天士力、恒瑞医药、以岭药业、翰宇药业、华海药业等。

资料来源:资产信息网 千际投行 iFinD
2.4 政策监管
行政监管部门为国家市场监督管理总局下设的国家药品监督管理局,为创新药研发行业的直接主管部门。根据《国家药品监督管理局职能配置、内设机构和人员编制规定》,医药市场监管实行分级管理,药品监管机构只设到省一级,药品经营销售等行为的监管由市县市场监管部门统一承担。
国家卫生健康委员会、国家医疗保障局也承担部分药品监管职能。国家卫生健康委员会会同国家药品监督管理局组织国家药典委员会并制定国家药典,建立重大药品不良反应和医疗器械不良事件相互通报机制和联合处置机制;会同国家医疗保障局等部门在医疗、医保、医药等方面加强制度、政策衔接,建立沟通协商机制,协同推进改革,提高医疗资源使用效率和医疗保障水平。
自律协会为中国医药创新促进会,工作内容主要包括:
开展医药政策研究,为我国医改事业、完善药物政策和医药产业发展建言献策;
通过举办各种论坛、发布会、大型会议等活动,促进会员单位乃至整个医药产业的相互交流、创新发展;
通过与国内外医药行业协会、企业、科研机构和外国驻华使馆合作,推动国际医药产业的多方位、多维度合作交流,为会员单位搭建国际交流平台;
践行国家创新驱动发展战略指导精神,为会员单位拓宽医药创新投融资渠道、搭建合作平台,推动社会资本加大对初创及研发型企业自主创新项目的投入,营造更有吸引力的医药创新投资环境;
为会员单位提供医药信息搜集、整理、评价服务,包括编辑每日《医药信息简报》、每周《国际医药产业发展动态与研发信息简报》等内部电子刊物以及中国药促会官方网站、微信公众号等服务平台。
2022年发布的主要行业政策有:
2022年1月,发展改革委发布《“十四五”生物经济发展规划》,主要内容为发展合成生物学技术,推动合成生物学技术创新。有序推动在新药开发、疾病治疗、农业生产、物质合成、环境保护、能源供应和新材料开发等领域应用。
2022年1月,工信部等发布《“十四五”医药工业发展规划》,主要内容为强化关键核心技术攻关,大力推动创新产品研发。
2022年1月,CDE发布《药审中心加快创新药上市申请审评工作程序(试行)(征求意见稿)》,主要内容为鼓励研究和创制新药,满足临床用药需求,及时总结转化抗疫应急审评工作经验,加快创新药品的审评速度。
2022年3月,CDE发布关于公开征求《单臂临床试验用于支持抗肿瘤药上市申请的适用性技术指导原则》意见的通知,单臂临床试验的研发策略显著地缩短了新药的上市时间;特别是近年来,许多新药在临床研究早期阶段就显现出非常突出的有效性数据,因此,越来越多的研发企业希望采用单臂临床试验支持抗肿瘤药物的上市申请。
2022年4月,CDE发布《药物临床试验期间方案变更技术指导原则(试行)》,针对进行中的临床试验,试验期间如申办方希望更改研究终点、增减对照组可按规定的流程沟通审批后,继续试验,提高了临床试验的灵活性和成功率。
2022年8月,药监局发布《中华人民共和国药品管理法实施条例(修订草案征求意见稿)》, 将药品专利链接制度将专利纠纷提前至药品上市申请阶段解决, 有助于明确仿制药知识产权的非侵权性,也有利于澄清原研药的保护范围。2020年10月17日全国人大常委会通过的《专利法》第76条首次确立了中国的药品专利链接制度。征求意见稿第38条。

图片新闻
技术文库
最新活动更多
-
4月23日立即报名>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
4月25日立即报名>> 【线下论坛】新唐科技2025新品发布会
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论