AI审批即将全力加速!药监局主导的人工智能医疗器械创新推进会干货梳理
距离正式向AI企业发布《深度学习辅助决策医疗器械软件审批要点》仅半月,药监局再次展开了AI器械审批相关的大动作。
7月17日,由国家药品监督管理局医疗器械技术审评中心、中央网络办国家计算机网络与信息安全管理中心、中国信息通信研究院、国家卫生健康委国际交流与交流中心、中国生物技术发展中心、中国生物医药工程学会、中国人民解放军总医院、中国医学科学院北京协和医院、四川大学华西医院、上海申康医院发展中心、清华大学、浙江大学、四川大学、华南理工大学联合主办的人工智能医疗器械创新推进会在京展开。国家药品监督管理局局长焦红、国家药品监督管理局副局长徐景和、国家药品监督管理局医疗器械技术审评中心副主任邓刚、国家局医疗器械技术审评中心主任孙磊、国家工业和信息化部党组成员、总工程师张峰均出席了本次会议。
大会之上,人工智能医疗器械创新合作平台在此成立。该平台以构建开放协同共享的人工智能医疗器械创新体系,形成服务于科学监管、科技创新、产品转化的人工智能医疗器械创新合作平台为目标愿景,将全力推动医学人工智能产品审批。
在此,动脉网记者对会议的部分内容进行了梳理,尝试帮助医疗AI的从业人员理清药监局审批的思路与要点,其内容包括主要包括以下三个方面:
一、人工智能医疗器械创新合作平台组织架构;
二、数据安全问题及相关建议;
三、数据库建立路径、数据库种类确立及数据库监控维护。
产学研多方参与平台搭建
人工智能医疗器械创新合作平台由中央国家机关事业单位、学会、医疗机构与高校共同参与构成。管理委员会统一管辖下属10个初期工作组,各个工作组又由不同的机构参与管理。
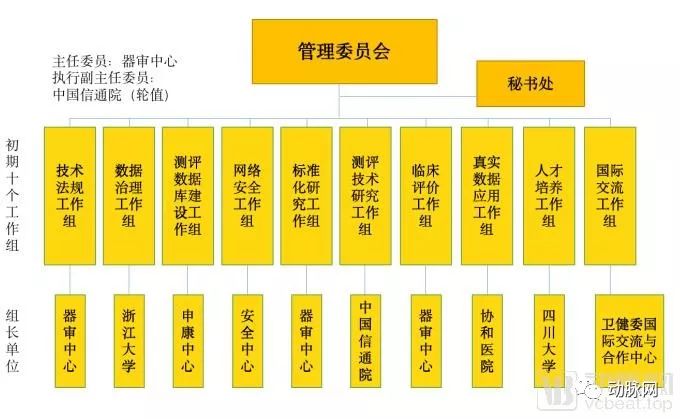
平台架构
从上图可以看到,器审中心兼任了医疗AI产品审批过程中最为重要的技术法规、标准化研究、临床评价三个工作组。测评数据库建设这一重要工作组由上海申康医院发展中心主要负责。而本次会议中重点提及的安全问题由中央网络办国家计算机网络与信息安全管理中心负责。
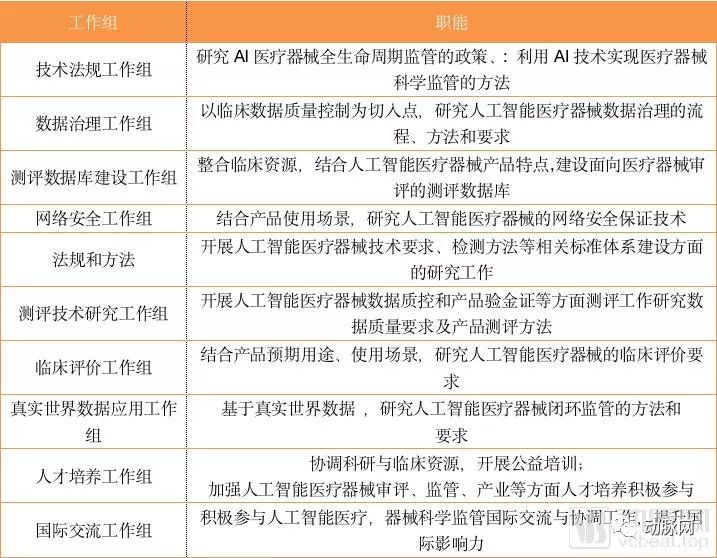
各工作组职能分布
从10个工作组的职能分布上看,本次会议可谓深思熟虑。创新平台不仅将审批常见的临床、数据标准化、网络安全等问题纳入考核之中,还将人工智能人才培养、人工智能国际监督交流等非政府机构职能纳入了并行工作组。
此外,与数据库相关的工作组高达三个,分别对检验数据库、真实世界数据、数据检验进行独立研究,足以看出器审中心对于数据这一AI核心要素的重视,这或许意味着数据将成为制约人工智能企业发展的关键。

最新活动更多
-
3月27日立即报名>> 【工程师系列】汽车电子技术在线大会
-
即日-4.22立即报名>> 【在线会议】汽车腐蚀及防护的多物理场仿真
-
4月23日立即报名>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
4月25日立即报名>> 【线下论坛】新唐科技2025新品发布会
-
在线会议观看回放>>> AI加速卡中村田的技术创新与趋势探讨
-
即日-5.15立即报名>>> 【在线会议】安森美Hyperlux™ ID系列引领iToF技术革新











 分享
分享















发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论