AI审批即将全力加速!药监局主导的人工智能医疗器械创新推进会干货梳理
CT肺、脑MRI、冠脉CTA等8种测试样本数据库样本数据将成立,申康中心承担建设工作
未来人工智能测评数据库将由上海申康医院发展中心负责建设,上海申康医院发展中心医联中心主任何萍在会上表示:申康中心将整合临床资源,结合人工智能医疗器械产品特点,以建设面向医疗器械审评的测评数据库。演讲内容由以下几个要点组成。
一、数据库建立方向
数据库的建立是人工智能产品审批的先行之举,过去仅存在肺结节和眼底两类影像,而且未确定测试数据库的类型。本次会议上,何萍先从宏观层面上讲述了数据库的建立路径,主要包含以下三点。
1. 将申康医联大数据基础上,建立起可高效用于人工智能研究和研发的专用“人工智能+医学影像类系统的审评技术及专业数据库”的标准、规范管理条例以及伦理学标准。
2. 开展示范应用,以不断改进和提升“人工智能+医学影像类系统的审评技术及专业数据库”。
3. 在此基础上建成“人工智能+医学影像类系统的审评技术及专业数据库” ,为全国大规模应用推广建立基础。
二、建库模式
在确立数据库的建设方向之后,数据的选择则是更为困难的一个问题。在这一方面,何萍提出了测试数据选择的多项要求,并声明企业可简洁参与。
1. 来源真实世界、拥有数据所有权、动态增长、多中心多样化的医疗数据。具体包括:采集38家三甲医院的全量诊疗数据+合作单位医疗数据目录库(动态增长);天然满足多中心、多设备、多模态等要求(多中心);保证未来测试数据具有多样、真实、可靠的数据来源(多样性);医疗数据的标准、种类、体量能满足各类数据抽样方法的要求(超大样本)。
2. 严格的数据资产管控
建设医疗大数据管控平台,更好地管理大数据资产(标准规范);完善的数据治理制度、标准、流程和系统(安全可控)。
3. 企业参与模式
在建设主体单位拥有建设主导权的情况下,企业可间接参与。
三、建设目标
那么,申康中心将在短期之后进行怎样的具体工作呢?何萍将其总结为“一二三四八”五点。
一指1个门户网站,即国家人工智能医学软件测评服务门户;
二指2个平台,即医学软件测评数据中台、医学软件测评服务平台;
三指3个数据中心,即全样本大数据中心、标注数据中心、测评数据中心;
四指4级数据质量治理技术体系,即医疗数据规范性质控、数据采集校验质控、数据融合质控、数据开发利用;
八指8种以上测试样本数据库:即CT肺、CT肝、 CT骨折、脑MRI、心脏MRI、冠脉CTA、心电、眼科……
此外,上海申康医院发展中心还将建立多个医学软件临床评价试验基地,包括上海申康、301、 四川华西、北京协和等。
同时,申康中心还将建设人工智能产品具体测评平台,其工作运行方式由下图所示。
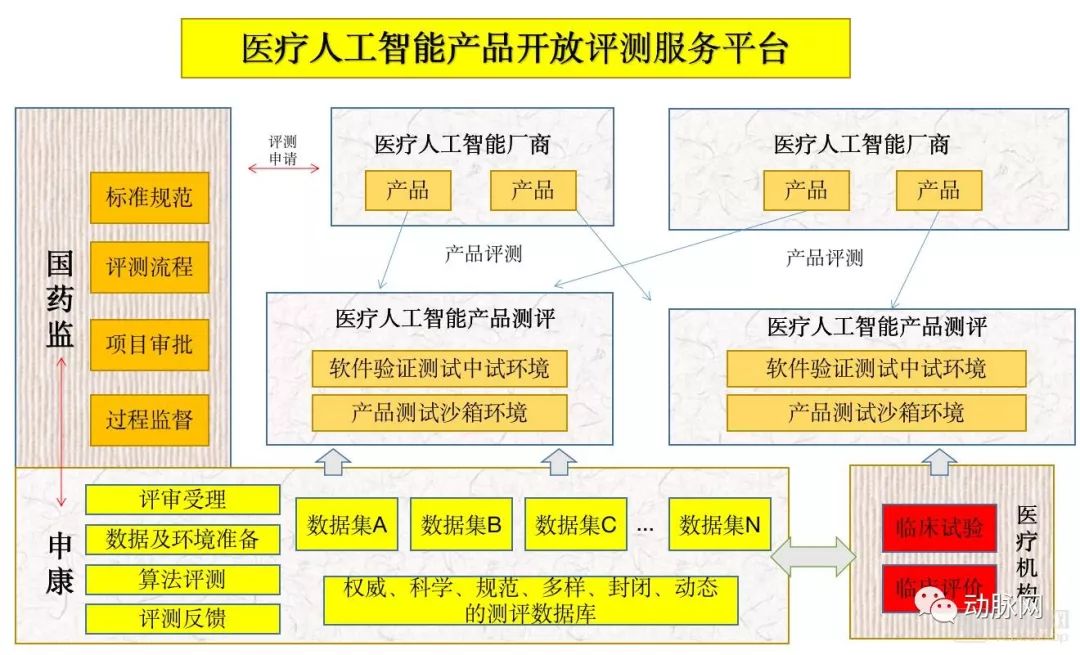
四、平台服务模式说明(数据管理)
构建数据库完成后,怎样使用数据库,并确保数据安全同样成为了本次演讲的重点,其内容可总结四点。
1. 构建“人工智能+医学影像类系统的审评技术及专业数据库”,统汇总各方数据目录,并提供搜索引擎及目录树,并将搜索的结果整合为最终结果反贵给用户,用户依据搜索结果与数据主体医院合作。门户运营方负责保证数据目录在各个主体之间、及对外反馈结果过程中的安全合规性。
2. 医院数据中心、区域数据中心:共同构建数据管控和应用平台,联合治理和管控好数据,并为各机构内部的临床研究、成果转化、人工智能应用需求提供服务。
3. 医院、区域等数据:数据不出机构,通过管控平台,仅提供数据目录给用户方进行索引。
4. 医院、区域等数据:提供结果分析数据给用户使用时,进行严格的数据监管,保障数据安全。
五、数据库监控
除去数据库建设、数据收集、规章制定外,申康中心还制定的严格的监控程序,这一点在过去未曾提及。
1. 资源计量统计报表:周期性对每个项目下的资源进行计量报表,并通过多种统计图表展现各个项目的资源使用量以及资源使用趋势,让管理员可以清晰地看到各个项目下资源的总量分析、趋势分析,为业务决策提供帮助;
2. 资源池容量分析:对数据中心以及对现网运营设备按负载率持续性、机型、负载指标统计出容量数据,及时发现低负载的空闲设备,提高资源的使用率,降低运营成本;
3. 周期报表:统计各类资源的用户使用量、每类资源的使用情况,如基础云平台、业务系统的CPU、内存、存储、IP的资源总量及占用量。周期性生成报表,并通过设置的邮件地址自动发送报表邮件。
在完成对申康中心的职能介绍后,何萍将申康中心的工作目标总结为以下四点。
1. 申康中心在国家药监局器审中心的带领下,联合好工作组和课题组,牢牢把握重要战略机遇期的科学判断,坚持推动高质量发展,加快推进医疗人工智能的建设发展。
2. 承担好人工智能医疗器械测评库数据方面的子课题负责人职能,建成基于人工智能的医疗测评数据库,对临床医疗数据进行编目、汇聚、整合,保障数据安全、推动医疗数据在人工智能医疗器械方面的利用;率先形成一套数据标准和管理规范。
3. 打通医疗人工智能研发应用所需的应用场景和数据,研究完善临床科研管理及创新体系,逐步形成未来智能医疗生态体系中价值贡献者的资源共建共享、业务协同、利益共享平台。
4. 激发医疗和科研机构创新活力,利用全球创新要素,探索从科学研究、到临床验证、再到技术转化的新模式,培育人工智能医疗与健康科技产业。
总结
大会同样提到了人工智能医疗器械审评指导原则体系构建。本次大会上的演讲主要是对6月28日国家药品监督管理局医疗器械技术审评中心发布的《深度学习辅助决策医疗器械软件审批要点》进行解读,其内容由适用范围、审批关注要点、软件更新、相关技术考量、注册申报资料说明五个方面组成。动脉网在《药监局发布医疗AI产品审批要点,人工智能企业是否准备就绪?》中已做梳理分析,这里不再赘述。
从整个会议内容来看,动脉网将其中的亮点提取为以下六点:
1. 体制的完善
在外部看来,过去的审批体制并不透明。相关各项职能集中于器审中心,但具体职能划分从外部难以洞察。此次创新合作平台的出现不仅将整个医疗AI审批的各项职能划分到了各个工作组,还将各个工作组分配到了不同机构。如今,整个流程已成体系,职能划分明确,这将极大推动AI产品审批进展。
2. 多方参与
创新合作平台的运作将不再由中央国家机关事业单位独立主导,学会、医疗机构以及高校纷纷加入其中。在当前阶段,医疗AI谈不上成熟,市场却需求强烈,所以产学研结合的模式既能一定程度上保障市场需求,又能在现有基础上继续深入研究。
3. 云平台安全问题
云平台安全问题一直饱受诟病,而此次网信办安全中心的调查则以数字的方式向各位展示了互联互通大环境下的真实状况。而需求孕育创新,为保障医联体的安全运行,国家将会加大在医院数据安全方面的投入,而这一痛点或许也将孕育一批新的紧跟市场的巨头。
4. 新的测试数据库建立计划
大会提出,CT肺、CT肝、 CT骨折、脑MRI、心脏MRI、冠脉CTA、心电、眼科等影像测试数据库建设将成为上海申康中心的目标,这八类产品囊括了市面上大部分人工智能产品。这项动作充分显示出了企业对政策的助推作用;同时,该计划也为医生使用这些产品打下了一针强心剂,药监局在一定程度上认可了这些产品未来;最后,数据库的建立意味着这几项产品将大概率先一步获得审批。
5. 明确的数据管理制度
在上海申康医院发展中心医联中心主任何萍的发言之中,我们能看到药监局严格规定了不同医疗机构、区域数据的流转规定及院方职能。这意味着过去部分院企打擦边球的手段将得到遏制。当然,更严格的监管意味着数据更难以获取,初创企业需要付出更多的成本,并以新的合作形式获取数据,已训练出成熟算法的公司或将因此壁垒高筑。
6. 风险评估指标制定
人工智能医疗器械审评指导原则体系强调了假阳性和假阴性的标准,在当前情况下,企业提供的数据多是来源不明的,准确性与敏感性都存在问题。该体系的制定或许会给予AI产品一个明确的质量判定指标。
从六点中可以看出,国药监局已在医疗AI产品审批推动方面下足了决心,但其中的临床评价事务仍值得注意。从平台体系可以看到,临床评价这一项工作依旧由器审中心负责,而当前的实际形式是各家企业仍难以通过临床实验评估。
真实数据应用组的工作或将有助于帮助企业通过临床试验,但这仍意味着企业需要对人工智能在真实世界的应用能力进行提升,要想AI落地于医院,这是AI企业永远绕不过的坎。所以,想要在医疗AI领域跑通,企业方还需继续求索。
感谢
本次会议资料由数坤科技CEO马春娥提供,数坤科技作为医疗人工智能头部企业也被邀参加了本次会议。马春娥认为,本次大会是国药监牵头,规格高,平台大,代表政府推动医疗人工智能产业发展的决心和实际行动。政企医研深度合作,会对行业规范化发展和规模化发展,起到积极的推动作用。

最新活动更多
-
3月27日立即报名>> 【工程师系列】汽车电子技术在线大会
-
即日-4.22立即报名>> 【在线会议】汽车腐蚀及防护的多物理场仿真
-
4月23日立即报名>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
4月25日立即报名>> 【线下论坛】新唐科技2025新品发布会
-
在线会议观看回放>>> AI加速卡中村田的技术创新与趋势探讨
-
即日-5.15立即报名>>> 【在线会议】安森美Hyperlux™ ID系列引领iToF技术革新











 分享
分享















发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论