诊疗费全免、试剂应急批、器械应急用!我们开了哪些医疗政策绿灯?
应急审批7个病毒检测试剂产品、未注册进口器械可应急使用、诊疗方案更新至第四版、确诊和疑似病例治疗均有医保保障……自新型冠状病毒感染的肺炎疫情发生以来,尤其是1月20日纳入乙类传染病并按甲类传染病管理之后,医疗卫生领域密集出台相关政策,以快速应对疫情防控。
据不完全统计,截至2月2日,国家卫健委、国家药监局、国家医保局总共已发布各类通知公告、工作方案与指南等30余条。
新型冠状病毒在被初步确认之前,其造成的病情被表述为“不明原因的病毒性肺炎”,即使是被初步确认后,科学界对它的认识、医护人员对疫情的认识,也是不断变化的,每一步都存在不确定性。
面对未知,国家政策除了遵循既有的应急流程之外,也在根据疫情变化做相应的突破。
药监局应急审批、助力进口
1月7日,专家初步判定武汉“不明原因的病毒性肺炎”病原体为新型冠状病毒,是对病毒认知的阶段性进展,使得后续诊断和治疗更有针对性。但随着疫情蔓延,病毒检测能力、急需器械的供应成为挑战。
>>>>
检测试剂应急审批,打通诊疗瓶颈
以武汉为例,武汉卫健委官网显示,疫情前期对疑似病例的样本检测流程如下:首诊医院通过规范的预检分诊、结合临床检查、实验室检查和胸部影像检查,经专家组会诊后确认疑似病例并采样,由辖区疾控中心将样本转运到市疾控中心,市疾控中心转运到省疾控中心进行核酸检测,每天可检测样本200多份;从采样开始到结果返回,约需2天左右。而在1月16日之前,湖北省没有试剂盒,还需要送到国家指定的检测机构进行病毒分离和核酸检测,结果返回约需3-5天。
病毒检测、病例确诊,是控制疫情关键的基础步骤。若疑似病例不能及时确诊,就无法及时对症治疗,延误治疗时机。
与此同时,国内体外诊断企业已迅速投入试剂研发,并取得阶段性成果。国家药监局同步行动,启动应急审批程序。
按照《医疗器械应急审批程序》规定,存在突发公共卫生事件威胁时,药品监管部门可对应急处理所需医疗器械实施应急审批。国家药监局根据突发公共卫生事件的情形和发展情况,决定启动及终止该程序的时间。
《体外诊断试剂注册管理办法》分类中,新型冠状病毒检测试剂属于与致病性病原体抗原、抗体以及核酸等检测相关的试剂,为第三类体外诊断产品。
根据上述《办法》和《程序》,我们梳理出了第三类体外诊断产品应急审批和普通审批的主要差异:
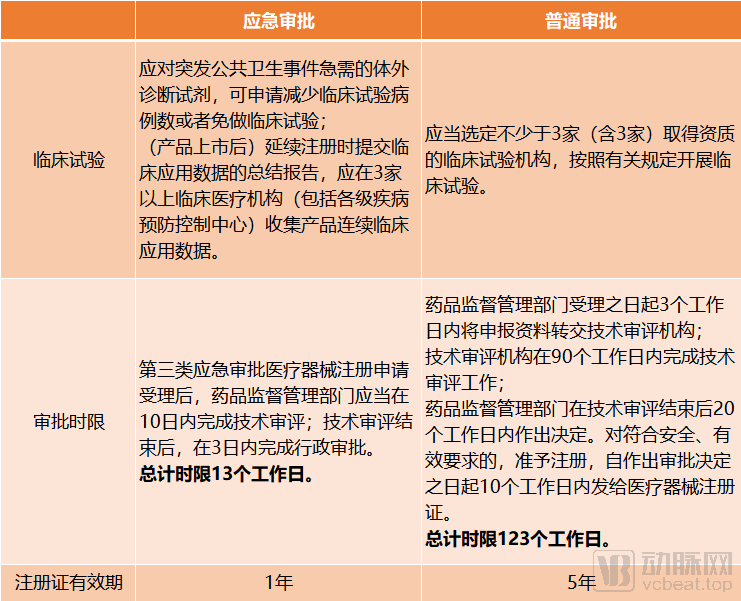
应急审批程序和普通审批程序对比,资料来源:国家药监局,动脉网制图
通过上图可知,应急审批降低了临床试验要求,注册环节的审评审批时限大大缩短,但注册证有效期仅1年,并要求企业在产品上市后补充资料,提交临床应用数据。这些差异,体现出应急使用和保证安全兼顾的原则。

图片新闻
技术文库
最新活动更多
-
4月23日立即报名>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
4月25日立即报名>> 【线下论坛】新唐科技2025新品发布会
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论