Dynacure:获5000万欧元C轮融资,专注孤儿病领域
由欧洲药物管理局(EMA)批准的具有“孤儿药标识”的产品将有资格在欧盟获得长达十年的市场独占权、有资格获得协议帮助,还可以使用欧盟的集中式营销授权程序。
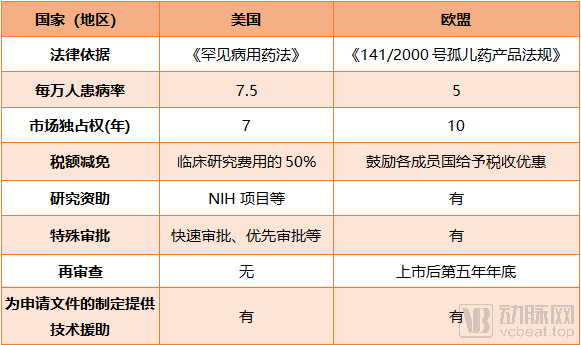
美国、欧盟对于孤儿病药物审批的相关优惠措施
这些政府的相关举措和出台法案对孤儿病药物的研发产生了显著的影响。近年来,罕见病用药研发已成为新药研发的主战场。
2018年全球罕见病用药市场规模为1310 亿美元,并以12.3%的年复合增长率快速增长,预计到2024年,罕见病用药市场规模将达到2420亿美元。罕见病用药市场增速是同时期非罕见病用药市场增速(6%)的两倍,预计到2024年,罕见病用药在处方药市场中的占比将初次突破20%。
1/2期“Unite-CNM”研究进行中,已有首位患者使用DYN101
2019年4月,Dynacure获得CTA批准,开始进行DYN101的第1/2期研究“Unite-CNM”。Unite-CNM(DYN101-C101)是一项欧洲多中心、递增剂量研究,旨在评估DYN101在约16岁以上XLCNM或ADCNM患者中的安全性、耐受性、药代动力学和初步疗效。
虽然1/2期研究的重点是在治疗12周后通过安全性、耐受性等目标来寻找最佳剂量的药物,但Dynacure还在探索分析DYN101的多个功效领域。
目前,在“ Unite-CNM”的1/2期研究中,Dynacure宣布已有首位CNM患者使用DYN101。首位患者用药一个月后,2020年4月2日,Dynacure宣布获得了C轮融资,以继续推进该试验。
国内罕见病市场情况
长时间以来,中国没有建立罕见病种类的统计数据和病种目录,也无明确的罕见病用药定义,所以在罕见病领域药物的注册生产上并未有快速发展。自2018年起,我国陆续出台相关政策支持罕见病用药的研发,加速了相关药物的研究进程。
2018年5月,国家卫生健康委、科技部、工信部等五部门联合印发了《第1批罕见病目录》,121种疾病被列入罕见病目录,加强国家对罕见病的管理;2019年2月,国家决定对头批21个罕见病药品和4个原料药实行降税优惠。
如今,我国政府已出台了罕见病药物领域降低罕见病用药进口关税、加速罕见病用药审评审批、将罕见病用药纳入医保等政策。多项政策的落实,极大地改善了罕见病患者“病无所医、医无所药、药无所保”的窘境,鼓舞了国内药企的信心,促使了更多药企加大对罕见药的研发投入。
目前,我国已诞生了北海康成、应诺医药、北京科信必成等罕见病用药研发企业。其中,北海康成建立了中国罕见病药物研发与商业一体化平台,通过引进国外技术、自主创新等方式推动了罕见病用药在中国上市。

图片新闻
技术文库
最新活动更多
-
4月23日立即报名>> 【在线会议】研华嵌入式核心优势,以Edge AI驱动机器视觉升级
-
4月25日立即报名>> 【线下论坛】新唐科技2025新品发布会
-
7.30-8.1火热报名中>> 全数会2025(第六届)机器人及智能工厂展
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
精彩回顾立即查看>> OFweek 2025(第十四届)中国机器人产业大会
-
精彩回顾立即查看>> 【在线会议】从直流到高频,材料电特性参数的全面表征与测量







 分享
分享












发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论